
| A.氯化钠溶液 | B.水 | C.醋酸钾溶液 | D.硫酸铜固体 |
科目:高中化学 来源:不详 题型:填空题
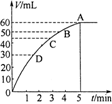
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
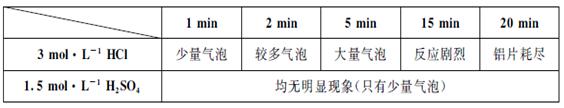
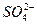 对该反应不影响。
对该反应不影响。 出主要实验步骤。
出主要实验步骤。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 化学反应 | 测量依据(单位时间内) |
| A | CO(g)+H2O(g)=CO2(g)+H2(g) | 压强变化 |
| B | Zn+H2SO4=ZnSO4+H2 | H2体积 |
| C | 2NO2?N2O4 | 颜色深浅 |
| D | Ca(OH)2+Na2CO3=CaCO3↓+2NaOH | 沉淀质量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用核磁共振氢谱可以鉴别l一溴丙烷和2一溴丙烷 |
B.对于可逆反应N2(g)+3H2(g)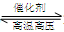 2NH3(g),增大氮气浓度可增加活化分子百分数,从而使反应速率增大 2NH3(g),增大氮气浓度可增加活化分子百分数,从而使反应速率增大 |
| C.将AlCl3溶液和NaAl02溶液分别蒸干后灼烧,所得固体产物均为Al2O3 |
| D.BaS04在同物质的量浓度的硫酸钠和硫酸铝溶液中的溶解度相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.15%的盐酸及10%的盐酸分别与锌反应速率不同,前者的反应速率一定比后者快 |
| B.在两个相同合成氨的装置中,其中一个每小时有100 kg氨生成,另一个每小时有50 kg氨生成,前者合成氨的速率比后者快2倍 |
| C.催化剂可以同等程度提高正逆反应速率 |
| D.增大压强(其他条件不变)一定可以增大HI气体分解的速率 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.20°C 时,将锌片放入0.01mol.L-1的稀盐酸中 |
| B.20°C 时,将锌片放入0.1mol.L-1的稀盐酸中 |
| C.50°C 时,将锌片放入0.01mol.L-1的稀盐酸中 |
| D.50°C 时,将锌片放入0.1mol.L-1的稀盐酸中 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol·L-1,0.1 mol·L-1,0.2 mol·L-1,当反应达到平衡时,各物质的浓度(mol·L-1)可以是(设趋向平衡的过程中内外无物质的交换)
2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol·L-1,0.1 mol·L-1,0.2 mol·L-1,当反应达到平衡时,各物质的浓度(mol·L-1)可以是(设趋向平衡的过程中内外无物质的交换)| A.SO2为0.4 O2为0.2 | B.SO2为0.26 |
| C.SO2和SO3都为0.18 | D.SO3为0.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com