
【题目】完成下列化学方程式
(1)过氧化钠与二氧化碳反应___________________________
(2)工业制漂白粉________________________
(3)氧化铝溶于氢氧化钠_____________________
(4)氢氧化亚铁在空气中被氧化_____________________
(5)铁与水蒸气高温下反应_____________________
【答案】2Na2O2+2CO2=2Na2CO3+O2 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O Al2O3+2NaOH=2NaAlO2+H2O 4Fe(OH)2+O2+2H2O=4Fe(OH)3 3Fe+4H2O(g)![]() Fe3O4+4H2
Fe3O4+4H2
【解析】
(1)过氧化钠与二氧化碳反应生成碳酸钠和氧气,方程式为:2Na2O2+2 CO2=2Na2CO3+O2;
(2)工业上将氯气通入石灰乳制取漂白粉,方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,
(3)氧化铝溶于氢氧化钠反应方程式为:Al2O3+2NaOH=2NaAlO2+H2O;
(4)氢氧化亚铁、氧气、水反应生成氢氧化铁,方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(5)铁与水蒸气在高温下的反应方程式为:3Fe+4H2O(g)![]() Fe3O4+4H2。
Fe3O4+4H2。


科目:高中化学 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法错误的是
A.常温下1LpH=2的H3PO4溶液中含有的H+数目为0.01NA
B.0.1mol苯被氧化为CO2转移的电子数为3NA
C.46.0g甘油(丙三醇)中共价键数目为6.5NA
D.18g重水(D2O)中含有的中子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H是合成有机光电材料的原料。H的一种合成路线如图:
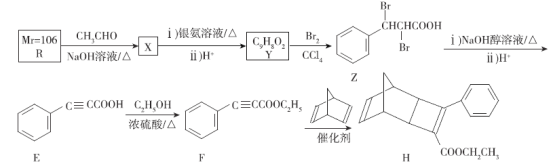
已知:R属于芳香族化合物,与新制Cu(OH)2悬浊液共热产生红色固体。请回答下列问题:
(1)R的化学名称是___________;X中官能团的名称是___________。
(2)F→H的反应类型是___________。
(3)E→F的化学方程式为______________。
(4)检验Z中溴元素的试剂有NaOH溶液、AgNO3溶液和___________。
(5)在Y的同分异构体中,同时具备下列条件的同分异构体有________种(不包含立体异构)。
①能发生银镜反应;②遇氯化铁溶液发生显色反应;③能与溴的四氯化碳溶液发生加成反应。
其中核磁共振氢谱有6组峰且峰面积比为1:1:1:1:2:2的结构简式为_________。
(6)参照上述流程,请设计以一溴环已烷和2-丁炔为起始原料制备![]() 的合成路线:__________(无机试剂任选)。
的合成路线:__________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,C(s)+CO2(g)![]() 2CO (g) ΔH>0。下列有关叙述正确的是
2CO (g) ΔH>0。下列有关叙述正确的是
A. 升高温度,v(正)增大,v(逆)减小
B. 增大压强,v(正)增大,v(逆)增大
C. 恒温恒压,再充入N2,反应速率不变
D. 增加炭的用量,v(正)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】屠呦呦率领团队先后经历了用水、乙醇、乙醚提取青蒿素的过程,最终确认只有采用低温、乙醚冷浸等方法才能成功提取青蒿素。研究发现青蒿素中的某个基团对热不稳定,该基团还能与NaI作用生成I2 。碳原子连有4个不同的原子或基团时,该碳称为手性碳,下列分析不正确的是
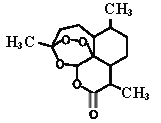
A. 推测青蒿素在乙醚中的溶解度大于在水中的溶解度
B. 青蒿素可以与NaOH、Na2CO3 、NaHCO3反应
C. 青蒿素分子中含有手性碳
D. 青蒿素中对热不稳定且具有氧化性的基团是“-O-O-”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积固定的密闭容器中存在如下反应A(g)+3B(g)![]() 2C(g);△H<0。某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图,下列判断一定错误的是( )
2C(g);△H<0。某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图,下列判断一定错误的是( )
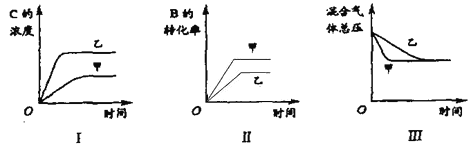
A.图 I 研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高
C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高
D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】髙分子聚合物Nomex芳纶(G)耐热性好、强度髙,是一种很好的绝热材料和阻燃纤维,下图是 Nomex芳纶的合成路线图:

(1)A的名称为___________;④的反应类型为___________;G的结构简式为___________。
(2)写出反应②的化学方程式:___________。
(3)B的芳香族同分异构体H具有三种含氧官能团,其各自的特征反应如下:
a.遇FeCl3溶液显紫色;b.可以发生水解反应;c.可发生银镜反应
符合以上性质特点的H共有___________种。
(4)下列有关F的说法正确的是___________(填字母序号)。
A.F的分子式为C14H12N2O3 B.F中只含有氨基和羧基两种官能团
C.F的核磁共振氢谱有11组吸收峰 D.F可以水解得到氨基酸
(5)聚氨基酸类物质以其无毒易降解特性广泛应用于药物载体,已知:CH3 CH2Cl+NH3![]() CH3CH2NH2+HCl,参照G的合成路线图,请以CH3CH2COOH为原料,无机试剂自选,写出合成聚2-氨基丙酸的合成路线图:___________。
CH3CH2NH2+HCl,参照G的合成路线图,请以CH3CH2COOH为原料,无机试剂自选,写出合成聚2-氨基丙酸的合成路线图:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C都为短周期元素,它们在周期表中的位置如图所示。已知B、C两元素在周期表中族序数之和是A元素族序数的2倍;B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C符合的一组是( )

A.铍、钠、铝B.硼、镁、硅C.碳、铝、磷D.氧、磷、氯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示。
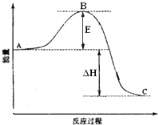
(已知1molSO2(g)氧化为1molSO3(g)的△H=-99kJ·mol-1。)请回答下列问题:
(1)图中A、C分别表示____、____,E的大小对该反应的反应热____(填“有”或“无”)影响。该反应通常用V2O5作催化剂,加V2O5会使图中B点____(填“变大”、“变小”或“不变”)。
(2)图中ΔH=____kJ·mol-1。
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化为V2O5。写也该催化循环机理的化学方程式____。
(4)已知单质硫的燃烧热为296kJ·mol-1,计算由S(s)生成3molSO3(g)的ΔH=____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com