
A.AgNO3溶液,稀盐酸 B.AgNO3溶液,Na3PO4溶液
C.AgNO3溶液,KI溶液 D.AgNO3溶液,NaBr溶液
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
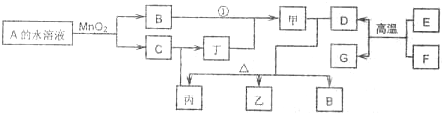
科目:高中化学 来源: 题型:阅读理解
| ||
| ||








查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
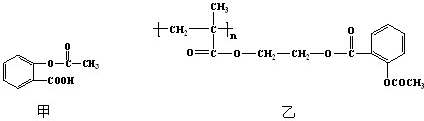
(A)有机化学反应因反应条件不同,可生成不同的有机产品。例如:

苯的同系物与卤素单质混合,若在光照条件下,侧链上氢原子被卤素原子取代;若在催化剂作用下,苯环上的氢原子被卤素原子取代。
工业上利用上述信息,按下列路线合成结构简式为 的物质,该物质是一种香料。
的物质,该物质是一种香料。

请根据上述路线,回答下列问题:
(1)A的结构简式可能为________________________。
(2)反应③⑤的反应类型分别为________________________、_____________________。
(3)反应④的化学方程式为(有机物写结构简式,并注明反应条件):_______________。
(4)工业生产中,中间产物A须经反应③④⑤得D,而不采取直接转化为D的方法,其原因是____________________________________________________________________。
(5)这种香料具有多种同分异构体,其中某些物质有下列特征:①其水溶液遇FeCl3溶液呈紫色;②分子中有苯环,且苯环上的一溴代物有两种。写出符合上述条件的物质可能的结构简式(只写两种):___________________________________。
28.(B)A、B、C、D、E都是短周期元素,原子序数依次增大,B、C同周期,C的非金属性最强,A、D同主族隔周期,E元素原子最外层的p亚层电子数是s亚层电子数的一半。A、B能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1。根据以上信息回答下列问题:
(1)甲、乙两分子中含有非极性共价键的物质的电子式是________________________,C元素在周期表中的位置是___________________________。
(2)C和D的离子中,半径较小的是_____________(填离子符号)。
(3)将D的单质投入甲中,待D消失后再向上述溶液中加入E的单质,此时发生反应的化学方程式是___________________________________________________________________。
(4)C、D、E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子D+(用![]() 表示)位于正方体的棱的中点和正方体内部;阴离子
表示)位于正方体的棱的中点和正方体内部;阴离子![]() (用
(用![]() 表示)位于该正方体的顶点和面心。该化合物的化学式是________________。
表示)位于该正方体的顶点和面心。该化合物的化学式是________________。

(5)如图,铁有δ、γ、α三种同素异形体,三种晶体在不同温度下能发生转化。下列说法正确的是( )
A.γ-Fe晶体中与每个铁原子距离相等且最近的铁原子有6个
B.α-Fe晶体中与每个铁原子距离相等且最近的铁原子有6个
C.若δ-Fe晶胞边长为a cm,α-Fe晶胞边长为b cm,则两种晶体密度比为2b3∶a3
D.将铁加热到1

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com