
| 2.24L |
| 22.4L/mol |
| 1 |
| 2 |
| 0.1mol |
| 0.2L |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��1����ѧƽ�ⳣ��K��ʾ���淴Ӧ�Ľ��г̶ȣ�KֵԽ��ʾ
��1����ѧƽ�ⳣ��K��ʾ���淴Ӧ�Ľ��г̶ȣ�KֵԽ��ʾ| ʱ�䣨min�� | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
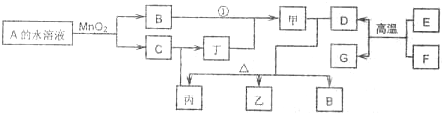
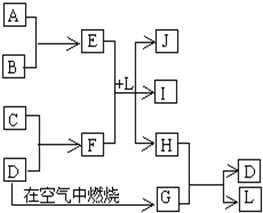 ��ͼÿһ�����е���ĸ����һ�ַ�Ӧ������������J�Ǻ�����Ԫ��A�İ�ɫ��״������IΪNaCl��Һ��D�ǵ���ɫ���嵥�ʣ�����д���пհף�
��ͼÿһ�����е���ĸ����һ�ַ�Ӧ������������J�Ǻ�����Ԫ��A�İ�ɫ��״������IΪNaCl��Һ��D�ǵ���ɫ���嵥�ʣ�����д���пհף�

 HS-+OH-
HS-+OH- HS-+OH-
HS-+OH-�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
(7��) (1)��ѧƽ�ⳣ��K��ʾ���淴Ӧ�Ľ��г̶ȣ�KֵԽ��ʾ_________��Kֵ��С���¶ȵĹ�ϵ�ǣ��¶����ߣ�Kֵ________(������С����������Ҳ���ܼ�С)��
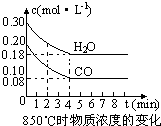
��2����һ���Ϊ10L�������У�ͨ��һ������CO��H2O����850��ʱ�������·�Ӧ��CO(g)ʮH2O(g) CO2(g)ʮH2 (g) ��H��0��CO��H2OŨ�ȱ仯������ͼ���� 0��4min��ƽ����Ӧ����v(CO)��______mol��(L��min)
t1��ʱ����Ũ�ȣ�mol/L���ı仯
| ʱ��(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 |
|
| 6 | 0.096 | 0.266 | 0.104 |
|
��3)t��(����850��)ʱ������ͬ�����з���������Ӧ�������ڸ����ʵ�Ũ�ȱ仯���������
�ٱ���3min��4min֮�䷴Ӧ����_________״̬�� C1��ֵ_________0.08 mol��L (����ڡ�С�ڻ����)��
�ڷ�Ӧ��4min��5min֮�䣬ƽ�����淽���ƶ������ܵ�ԭ����________(��ѡ)������5min��6min֮����ֵ�����仯�����ܵ�ԭ����__________(��ѡ)��
a������ˮ���� b�������¶� c��ʹ�ô��� d����������Ũ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ�����ʡ������ѧ��11�·��¿���ѧ�Ծ� ���ͣ�ѡ����
(7��) (1)��ѧƽ�ⳣ��K��ʾ���淴Ӧ�Ľ��г̶ȣ�KֵԽ��ʾ_________��Kֵ��С���¶ȵĹ�ϵ�ǣ��¶����ߣ�Kֵ________(������С����������Ҳ���ܼ�С)��
��2����һ���Ϊ10L�������У�ͨ��һ������CO��H2O����850��ʱ�������·�Ӧ��CO(g)ʮH2O(g)
 CO2(g)ʮH2 (g) ��H��0��CO��H2OŨ�ȱ仯������ͼ���� 0��4min��ƽ����Ӧ����v(CO)��______
mol��(L��min)
CO2(g)ʮH2 (g) ��H��0��CO��H2OŨ�ȱ仯������ͼ���� 0��4min��ƽ����Ӧ����v(CO)��______
mol��(L��min)

t1��ʱ����Ũ�ȣ�mol/L���ı仯
|
ʱ��(min) |
CO |
H2O |
CO2 |
H2 |
|
0 |
0.200 |
0.300 |
0 |
0 |
|
2 |
0.138 |
0.238 |
0.062 |
0.062 |
|
3 |
C1 |
C2 |
C3 |
C3 |
|
4 |
C1 |
C2 |
C3 |
C3 |
|
5 |
0.116 |
0.216 |
0.084 |
|
|
6 |
0.096 |
0.266 |
0.104 |
|
��3)t��(����850��)ʱ������ͬ�����з���������Ӧ�������ڸ����ʵ�Ũ�ȱ仯���������
�ٱ���3min��4min֮�䷴Ӧ����_________״̬�� C1��ֵ_________0.08 mol��L (����ڡ�С�ڻ����)��
�ڷ�Ӧ��4min��5min֮�䣬ƽ�����淽���ƶ������ܵ�ԭ����________(��ѡ)������5min��6min֮����ֵ�����仯�����ܵ�ԭ����__________(��ѡ)��
a������ˮ���� b�������¶� c��ʹ�ô��� d����������Ũ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com