
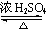 CH3COOCH2CH=CH2+H218O,酯化反应生成的产物在一定条件下可以发生加聚反应得到高分子化合物,其结构简式为
CH3COOCH2CH=CH2+H218O,酯化反应生成的产物在一定条件下可以发生加聚反应得到高分子化合物,其结构简式为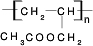 .
.分析 CH2=CH-CH2OH含有羟基,可发生取代、消去和氧化反应,可与钠反应生成氢气,含有碳碳双键,可发生加成、加聚和氧化反应,以此解答该题.
解答 解:(1)由结构简式可知丙烯醇含有的官能团为碳碳双键、羟基,故答案为:羟基;
(2)0.1mol 烯丙醇与足量金属钠反应,发生2CH2=CH-CH2OH+2Na→2CH2=CH-CH2ONa+H2↑,生成氢气0.05mol,体积为1.12L,故答案为:1.12L;
(3)丙烯醇含有碳碳双键,可与溴水发生加成反应,反应的方程式为CH2=CH-CH2OH+Br2→CH2BrCHBrCH2OH,
故答案为:CH2=CHCH2OH+Br2→CH2BrCH2BrCH2OH;
(4)烯丙醇与CH3CO18OH发生酯化反应的化方程式为CH3CO18O H+CH2=CH-CH2OH 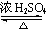 CH3COOCH2CH=CH2+H218O,酯化反应生成的产物在一定条件下可以发生加聚反应得到聚丙烯酸乙酯,结构简式为
CH3COOCH2CH=CH2+H218O,酯化反应生成的产物在一定条件下可以发生加聚反应得到聚丙烯酸乙酯,结构简式为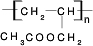 ,
,
故答案为:CH3CO18O H+CH2=CH-CH2OH 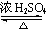 CH3COOCH2CH=CH2+H218O;
CH3COOCH2CH=CH2+H218O; ;
;
(5)烯丙醇的一种同分异构体能发生银镜反应,应含有醛基,为丙醛,其结构简式为,故答案为:CH3CH2CHO.
点评 本题考查有机物的结构与性质,为高频考点,侧重于学生的分析能力的考查,注意把握有机物中官能团与性质的关系是解答的关键,注重基础知识的考查,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 甲苯与溴水 | B. | 乙酸钠溶液与硫酸 | ||
| C. | 甲苯与KMnO4酸性溶液 | D. | 甲酸溶液与银氨溶液水浴共热 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验步骤 | 实验结论 氧化性从强到弱的顺序:氯、溴、碘 |
| ①氯水+1mL CCl4,振荡,静置,观察四氯化碳层颜色 | |
| ②NaBr溶液+氯水+1mL CCl4,振荡,静置,观察四氯化碳层颜色 | |
| ③KI溶液+氯水+1mL CCl4,振荡,静置,观察四氯化碳层颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5Q | B. | Q | C. | 2Q | D. | 5Q |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室制备Cl2,可用排饱和食盐水集气法收集 | |
| B. | 浓盐酸与KMnO4制氯气的离子方程式是:MnO4-+8H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+4H2O | |
| C. | 漂白粉溶液在空气中失效变化的离子方程式是:ClO-+CO2+H2O=HClO+HCO3- | |
| D. | H2O2具有很强的氧化性,在化学反应中只能作氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
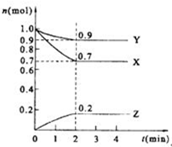 某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
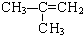 互为同分异构体,关于它们的性质叙述正确的是( )
互为同分异构体,关于它们的性质叙述正确的是( )| A. | 它们的分子式相同,物理性质相同 | |
| B. | 它们都具有碳碳双键,与H2加成的产物完全相同 | |
| C. | 它们都能使酸性高锰酸钾溶液褪色 | |
| D. | 它们都符合通式CnH2n-2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com