
【题目】掌握仪器的名称、组装及使用方法是中学化学实验的基础,根据下图所示实验装置,回答下列问题。
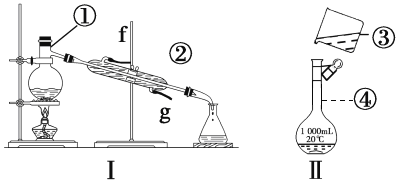
(1)写出下列仪器的名称:
①_____________②________________,④______________________
(2)仪器①~④中,使用时必须检查是否漏水的是_______________________(填序号)。
(3)若利用装置Ⅰ分离酒精和水的混合物,还缺少的仪器________________,将仪器补充完整后进行的实验操作的名称为__________________②的进水口是____________(填“f”或“g”)。
(4)现需配制250mL、0.2mol·L1NaCl溶液,装置Ⅱ是某同学转移溶液的示意图,指出图中的错误操作:_____________________
【答案】蒸馏烧瓶 冷凝管 容量瓶 ④ 温度计 蒸馏 g 未用玻璃棒引流;未采用250ml容量瓶
【解析】
(1)下列仪器的名称:①蒸馏烧瓶,②冷凝管,④容量瓶
(2)容量瓶是配制一定物质的量浓度溶液的精密度较高的仪器,在使用前,需检查其是否漏液。
(3)分离酒精和水的混合物,采用的操作方法为蒸馏,对照蒸馏装置可确定装置Ⅰ还缺少的仪器;冷凝管中,时刻要确保冷却水的充满。
(4)配制250mLNaCl溶液,首先考虑选择250mL的容量瓶,其次还应有烧杯、玻璃棒、胶头滴管等,对照检查,便可确定缺少的仪器。
(1)①蒸馏烧瓶 ②冷凝管 ④容量瓶,故答案为:蒸馏烧瓶;冷凝管;容量瓶;
(2)仪器①~④中,使用时必须检查是否漏水的是容量瓶,故答案为:④;
(3)若利用装置Ⅰ分离酒精和水的混合物,还缺少的仪器为温度计,将仪器补充完整后进行的实验操作的名称为蒸馏;②的进水口是g,故答案为:温度计;蒸馏;g;
(4)装置Ⅱ图中的错误操作:未用玻璃棒引流;未采用250ml容量瓶,故答案为:未用玻璃棒引流;未采用250ml容量瓶。


 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】硝基苯是制造染料的重要原料,某同学在实验室里用如图所示装置制取硝基苯,主要步骤如下:

①在大试管里将2 mL浓硫酸和1.5 mL浓硝酸混合,摇匀,冷却到50~60 ℃以下;然后逐滴加入1 mL苯,边滴边振荡试管。
②按图连接好装置,将大试管放入60 ℃的水浴中加热10分钟。
完成下列填空:
(1)指出上图中的错误:__________、____________。
(2)向混合酸中加入苯时,“逐滴加入”“边滴边振荡试管”的目的是__________________________。
(3)反应一段时间后,混合液明显分为两层,上层主要物质是________(填物质名称)。把反应后的混合液倒入盛有冷水的烧杯里,搅拌,可以看到________(填字母)。
a.水面上是含有杂质的硝基苯
b.水底有苦杏仁味的液体
c.烧杯中的液态有机物只有硝基苯
d.有无色、油状液体浮在水面
(4)为了获得纯硝基苯,实验步骤:①水洗、分液;②将粗硝基苯转移到盛有__________的烧杯中洗涤、用__________(填仪器名称)进行分离;③__________;④干燥;⑤__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中,甲是电解饱和食盐水,乙是铜的电解精炼,丙是电镀,回答:

(1)b极上的电极反应式为__,甲电池的总反应化学方程式是__。
(2)在粗铜的电解过程中,图中c电极的材料是__(填“粗铜板”或“纯铜板”);在d电极上发生的电极反应为__;若粗铜中还含有Au、Ag、Fe等杂质,则沉积在电解槽底部(阳极泥)的杂质是__,电解一段时间后,电解液中的金属离子有__。
(3)如果要在铁制品上镀镍(二价金属,相对原子质量59),则f电极的材料是__(填“铁制品”或“镍块”,下同),e电极的材料是__。
(4)若e电极的质量变化118 g,则a电极上产生的气体在标准状况下的体积为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是 ( )
A. 2 mol H2O的摩尔质量和1 mol H2O的摩尔质量
B. 200 mL 1 mol·L-1氯化钙溶液中c(Cl-)和100 mL 2 mol·L-1氯化钾溶液中c(Cl-)
C. 64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数
D. 20% NaOH溶液中NaOH的物质的量浓度和10% NaOH溶液中NaOH的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组用数字实验系统测定一定浓度碳酸钠溶液的pH与温度的关系,得到如图所示曲线。下列分析不正确的是
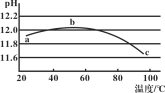
A.b点溶液中OH-浓度在整个过程中最大
B.水的电离平衡也会对溶液的pH产生影响
C.a→b段水解平衡向右移动
D.a点溶液显碱性,且离子浓度从大到小为:Na+>CO32->OH->HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某化合物A由两种元素组成,可以发生如下的转化。
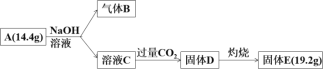
已知:标准状况下,气体B的密度是氢气的8倍。请回答:
(1)组成A的元素有_________,A的化学式是_________
(2)请写出A与NaOH溶液反应的化学方程式_________
(3)A可用于金属的冶炼,请写出A与Fe2O3的化学反应方程式_________
Ⅱ.某实验小组做了如下实验:

请回答:
(1)写出硬质管中发生反应的化学方程式:_________
(2)有同学认为乙醇的催化氧化反应产物中含有乙酸,请设计实验检验产物成分:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)25 ℃下,0.1mol/L氨水的电离度为1%,则此温下,该溶液的pH=______。
(2)25 ℃下,pH=2的硫酸溶液Va mL与pH=10的NaOH溶液Vb mL恰好中和,则,Va:Vb=___________。
(3)某温下,水的离子积常数KW=1.0×10-13。该温下,0.2mol·L-1的NaHSO4溶液与0.2mol·L-1的Ba(OH)2溶液等体积混合,混合后溶液的pH=______。
(4)一定条件下,可逆反应A2(g)+B2(g)2AB(g)达到化学平衡,经测定平衡时c(A2)=0.5 mol·L-1,c(B2)=0.1 mol.L-1,c(AB)=1.4 mol·L-1,若A2、B2、AB的起始浓度分别以a、b、c表示。请回答:
①a、b应满足的关系是_________。
②a的取值范围是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或有关化学用语的表达不正确的是
A. 在基态多电子原子中,p轨道电子能量不一定高于s轨道电子能量
B. 核外电子排布由1s22s22p63s1→1s22s22p6 的变化需要吸收能量
C. 某元素基态原子的电子排布图![]()
D. Ca2+离子基态电子排布式为1s22s22p63s23p6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积恒定的密闭容器中发生可逆反应A(g)+3B(g) ![]() 2C(g),下列叙述一定是达到平衡的标志的是
2C(g),下列叙述一定是达到平衡的标志的是
①2υ(B)正=3υ(C)逆;②单位时间内生成a mol A,同时消耗2a mol C;③A、B、C的浓度不再变化;④混合气体的总压强不再变化;⑤C的质量分数不再改变;⑥用A、B、C的物质的量浓度变化表示的反应速率之比为1:3:2的状态;⑦A、B、C的浓度彼此相等;⑧混合气体的密度不再改变的状态
A. ①③④⑤ B. ①④⑤⑦ C. ④⑤⑥⑧ D. ③⑤⑥⑦
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com