
【题目】
(1)25 ℃下,0.1mol/L氨水的电离度为1%,则此温下,该溶液的pH=______。
(2)25 ℃下,pH=2的硫酸溶液Va mL与pH=10的NaOH溶液Vb mL恰好中和,则,Va:Vb=___________。
(3)某温下,水的离子积常数KW=1.0×10-13。该温下,0.2mol·L-1的NaHSO4溶液与0.2mol·L-1的Ba(OH)2溶液等体积混合,混合后溶液的pH=______。
(4)一定条件下,可逆反应A2(g)+B2(g)2AB(g)达到化学平衡,经测定平衡时c(A2)=0.5 mol·L-1,c(B2)=0.1 mol.L-1,c(AB)=1.4 mol·L-1,若A2、B2、AB的起始浓度分别以a、b、c表示。请回答:
①a、b应满足的关系是_________。
②a的取值范围是___________。
【答案】11 1:100 12 a=b+0.4 或(a-0.5):(b-0.1)=1:1 0.4mol/L≤a≤1.2mol/L
【解析】
(1)氨水溶液中c(OH-)=c(氨水) ×电离度;
(2)硫酸溶液和氢氧化钠溶液恰好中和说明酸溶液中氢离子物质的量等于碱溶液中氢氧根物质的量;
(3)先计算混合溶液中过量c(OH-),在依据水的离子积常数计算pH;
(4)①由题意建立三段式,依据变化量之比等于化学计量数之比求解;
②平衡建立可能从正反应开始,也可能从逆反应开始。
(1)25℃下,0.1mol/L氨水的电离度为1%,溶液中c(OH-)=0.1mol/L×1%=0.001mol/L,则该溶液的pH=14-3=11,故答案为11;
(2)25 ℃下,pH=2的硫酸溶液VamL与pH=10的NaOH溶液VbmL恰好中和,则有10-2mol/L×Va×10-3L=10-4mol/L×Vb×10-3 L,解得Va:Vb=1:100,故答案为1:100;
(3)0.2 mol/LNaHSO4溶液中c(H+)=0.2mol/L,0.2mol/ LBa(OH)2溶液中c(OH-)=0.4mol/L,等体积混合后溶液中c(OH-)=![]() mol/L=0.1mol/L,则混合后溶液的pH=13-1=12,故答案为12;
mol/L=0.1mol/L,则混合后溶液的pH=13-1=12,故答案为12;
(4)①由题意建立如下三段式:
A2(g) + B2(g) ![]() 2AB(g)
2AB(g)
起(mol/L)a b c
变(mol/L)a-0.5 b-0.1 1.4-c
平(mol/L)0.5 0.1 1.4
由变化量之比等于化学计量数之比可得a-0.5=b-0.1,解得a=b+0.4,故答案为:a=b+0.4 或(a-0.5):(b-0.1)=1:1;
②若起始从正反应开始,则有如下三段式:
A2(g) + B2(g) ![]() 2AB(g)
2AB(g)
起(mol/L)a b 0
变(mol/L)a-0.5 b-0.1 1.4
平(mol/L)0.5 0.1 1.4
由变化量之比等于化学计量数之比可得2(a—0.5)=1.4,解得a=1.2;
若起始从逆反应开始,则有如下三段式:
A2(g) + B2(g) ![]() 2AB(g)
2AB(g)
起(mol/L)a 0 c
变(mol/L)0.5-a 0.1 0.2
平(mol/L)0.5 0.1 1.4
由变化量之比等于化学计量数之比可得0.5-a=0.1,解得a=0.4,则a的取值范围为0.4mol/L≤a≤1.2mol/L,故答案为:0.4mol/L≤a≤1.2mol/L。


科目:高中化学 来源: 题型:
【题目】PbO2、KMnO4、Cl2、FeCl3、CuCl2的氧化性依次减弱。下列反应不可能发生的是( )
A.Cu+2Fe3+=Cu2++2Fe2+
B.5Pb2++2![]() +2H2O=5PbO2↓+2Mn2++4H+
+2H2O=5PbO2↓+2Mn2++4H+
C.Cu+Cl2 ![]() CuCl2
CuCl2
D.10Cl-+2![]() +16H+=2Mn2++5Cl2↑+8H2O
+16H+=2Mn2++5Cl2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某种氨基酸(CxHyOzNm)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气。按下图所示装置进行实验。

回答下列问题:
(1)实验开始时,首先通入一段时间的氧气,其理由是__________________。
(2)以上装置中需要加热的仪器有_______ (填写字母),操作时应先点燃_____处的酒精灯。
(3)A装置中发生反应的化学方程式是____________________________。
(4)D装置的作用是____________________________。
(5)读取氮气的体积时,应注意①_________________;②_________________。
(6)实验中测得氮气的体积为VmL(标准状况),为确定此氨基酸的分子式,还需要的有关数据有____________________。
A.生成二氧化碳气体的质量
B.生成水的质量
C.通人氧气的体积
D.氨基酸的相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器的名称、组装及使用方法是中学化学实验的基础,根据下图所示实验装置,回答下列问题。
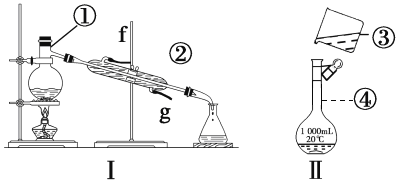
(1)写出下列仪器的名称:
①_____________②________________,④______________________
(2)仪器①~④中,使用时必须检查是否漏水的是_______________________(填序号)。
(3)若利用装置Ⅰ分离酒精和水的混合物,还缺少的仪器________________,将仪器补充完整后进行的实验操作的名称为__________________②的进水口是____________(填“f”或“g”)。
(4)现需配制250mL、0.2mol·L1NaCl溶液,装置Ⅱ是某同学转移溶液的示意图,指出图中的错误操作:_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烯是一种重要的化工原料,可采用乙苯催化脱氢法制备,反应如下:![]() (g)
(g)![]()
![]() (g)+H2(g) ΔH = +117.6kJ·mol-1
(g)+H2(g) ΔH = +117.6kJ·mol-1
(1)往刚性恒容容器中同时通入乙苯和水蒸气,测得容器总压和乙苯转化率随时间变化结果如图所示。
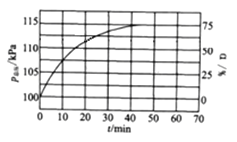
①平衡时,p(H2O)=_________,平衡常数Kp=_________kPa(Kp为以分压表示的平衡常数,请列式计算)
②下列说法正确的是_________
A.当混合气体的平均相对分子质量不再改变,反应达到平衡状态
B.增加通入水蒸气的量,有利于乙苯转化率的高
C.若将该反应置于恒压容器中反应,其他起始条件相同,乙苯的转化率将减小
D.仅往该刚性恒容容器中通入和上述等量的乙苯,其他条件相同,平衡时氢气的分压不变
(2)CO2气氛下乙苯催化脱氢可同时存在以下两种途径:

①请画出途径1的能量和反应过程的图像,并作适当标注______________

②途径I的反应历程如图所示,下列说法正确的是_________

A. CO2为氧化剂
B. 状态1到状态2形成了O-H键
C. 中间产物只有(![]() )
)
D. 该催化剂可提高乙苯的平衡转化率
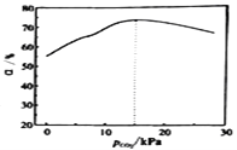
③刚性容器中,在催化剂作用下,一定时间内p(CO2)与乙苯转化率关系如图分析,则p(CO2)为15kPa时,乙苯转化率最高的可能原因_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】山梨醇[CH2OH(CHOH)4CH2OH]可用作牙膏、食品的水分保持剂。其生产路线如下图所示。下列说法错误的是
![]()
A.活性炭脱色的过程为物理变化
B.加压氢化时葡萄糖中醛基转化为羟基
C.离子交换时可选用阴离子交换树脂
D.山梨醇可作水分保持剂是因为能与水形成氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA为阿伏伽德罗常数的值。下列说法不正确的是( )
A. 12g金刚石中平均含有2NA个σ键
B. 1mol SiO2晶体中平均含有4NA个σ键
C. 12g石墨中平均含1.5NA个σ键
D. 1mol CH4中含4NA个s﹣p σ键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基甲酸铵发生分解的化学方程式为NH2COONH4(s)![]() 2NH3(g) + CO2(g)。利用如下装置测定不同温度下该反应以分压表示的化学平衡常数Kp,实验步骤如下:
2NH3(g) + CO2(g)。利用如下装置测定不同温度下该反应以分压表示的化学平衡常数Kp,实验步骤如下:
(Ⅰ)关闭K3,打开K1和K2,开启真空泵抽气至测压仪数值稳定后关闭K1;
(Ⅱ)关闭K2,缓慢开启K3至U型管两边液面相平并保持不变,读取压强数值。记录25℃、30℃下压强分别为12.0 kPa、17.1 kPa。下列说法错误的是
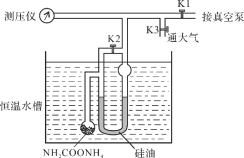
A.氨基甲酸铵分解反应的ΔH>0
B.该反应25℃时的化学平衡常数Kp = 2.56×1011 Pa3
C.步骤Ⅰ中测压仪数值未稳定即关闭K1,Kp测量值偏小
D.步骤Ⅱ中读数时U型管左侧液面偏高,Kp测量值偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.下图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法正确的是
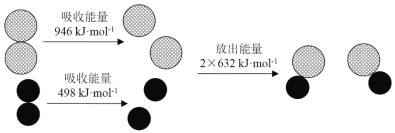
A. 1 mol N2(g)和NA个O2(g)反应放出的能量为180 kJ
B. 1 mol N2(g)和1 mol O2(g)具有总能量小于2 mol NO(g)具有的总能量
C. 通常情况下,N2(g)和O2(g)混合能直接生成NO(g)
D. 吸热反应一定需要加热才能发生
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com