
【题目】山梨醇[CH2OH(CHOH)4CH2OH]可用作牙膏、食品的水分保持剂。其生产路线如下图所示。下列说法错误的是
![]()
A.活性炭脱色的过程为物理变化
B.加压氢化时葡萄糖中醛基转化为羟基
C.离子交换时可选用阴离子交换树脂
D.山梨醇可作水分保持剂是因为能与水形成氢键
科目:高中化学 来源: 题型:
【题目】用惰性电极电解物质的量浓度相同、体积比为1∶2的CuSO4和NaCl的混合溶液,可能发生的反应有( )
①2Cu2++2H2O![]() 2Cu+4H++O2↑
2Cu+4H++O2↑
②Cu2++2Cl-![]() Cu+Cl2↑
Cu+Cl2↑
③2Cl-+2H+![]() H2↑+Cl2↑
H2↑+Cl2↑
④2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
A.①②③ B.①②④ C.②③④ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是 ( )
A. 2 mol H2O的摩尔质量和1 mol H2O的摩尔质量
B. 200 mL 1 mol·L-1氯化钙溶液中c(Cl-)和100 mL 2 mol·L-1氯化钾溶液中c(Cl-)
C. 64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数
D. 20% NaOH溶液中NaOH的物质的量浓度和10% NaOH溶液中NaOH的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某化合物A由两种元素组成,可以发生如下的转化。
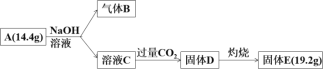
已知:标准状况下,气体B的密度是氢气的8倍。请回答:
(1)组成A的元素有_________,A的化学式是_________
(2)请写出A与NaOH溶液反应的化学方程式_________
(3)A可用于金属的冶炼,请写出A与Fe2O3的化学反应方程式_________
Ⅱ.某实验小组做了如下实验:

请回答:
(1)写出硬质管中发生反应的化学方程式:_________
(2)有同学认为乙醇的催化氧化反应产物中含有乙酸,请设计实验检验产物成分:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)25 ℃下,0.1mol/L氨水的电离度为1%,则此温下,该溶液的pH=______。
(2)25 ℃下,pH=2的硫酸溶液Va mL与pH=10的NaOH溶液Vb mL恰好中和,则,Va:Vb=___________。
(3)某温下,水的离子积常数KW=1.0×10-13。该温下,0.2mol·L-1的NaHSO4溶液与0.2mol·L-1的Ba(OH)2溶液等体积混合,混合后溶液的pH=______。
(4)一定条件下,可逆反应A2(g)+B2(g)2AB(g)达到化学平衡,经测定平衡时c(A2)=0.5 mol·L-1,c(B2)=0.1 mol.L-1,c(AB)=1.4 mol·L-1,若A2、B2、AB的起始浓度分别以a、b、c表示。请回答:
①a、b应满足的关系是_________。
②a的取值范围是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤、水煤气、甲醇、乙醇等都是重要的化工原料。
(1)水煤气生产原理是:C(s)+H2O(g) ![]() CO(g)+ H2(g) ΔH = +131.3kJ·mol-1。
CO(g)+ H2(g) ΔH = +131.3kJ·mol-1。
①能说明该反应达到平衡状态的是______(填字母)。
A.v正(CO)= v正(H2) B.c(CO)=c(H2)
C.恒容容器中,气体密度不变 D.恒容容器中,气体压强不变
②该反应达到化学平衡时,若要增大水蒸气的转化率可采取的措施是____(填字母)。
A.增加碳的物质的量 B.增加水蒸气的物质的量
C.增大压强 D.升高温度
(2)已知:CO(g)+ 2H2 (g)![]() CH3OH(g)。等物质的量的 CO与H2在催化剂作用下反应生成甲醇,平衡后若将容器的容积压缩为原来的一半(其他条件不变),对平衡体系产生的影响是______(填字母)。
CH3OH(g)。等物质的量的 CO与H2在催化剂作用下反应生成甲醇,平衡后若将容器的容积压缩为原来的一半(其他条件不变),对平衡体系产生的影响是______(填字母)。
A.c( H2 )减少 B.CH3OH 的物质的量增加 C.重新平衡时![]() 减小
减小
(3)已知6H2(g)+2CO2(g) ![]() CH3CH2OH(g)+3H2O(g) 。在温度为T℃,容积不变的密闭容器中,将3mol H2和1mol CO2混合,达到平衡时CO2气体的体积分数为a。
CH3CH2OH(g)+3H2O(g) 。在温度为T℃,容积不变的密闭容器中,将3mol H2和1mol CO2混合,达到平衡时CO2气体的体积分数为a。
①达到平衡时,转化率α(H2):α(CO2) = ______。
②恒容下,再向该容器中充入2mol He,则H2的转化率______(填“增大” 、“减小” 或“不变”)。
③在T℃,容积可变的密闭容器中将3mol H2和1mol CO2混合,达到平衡时CO2气体的体积分数_______a(填“>” 、“<” 或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或有关化学用语的表达不正确的是
A. 在基态多电子原子中,p轨道电子能量不一定高于s轨道电子能量
B. 核外电子排布由1s22s22p63s1→1s22s22p6 的变化需要吸收能量
C. 某元素基态原子的电子排布图![]()
D. Ca2+离子基态电子排布式为1s22s22p63s23p6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.若要完全沉淀相同体积的NaCl、MgCl2、AlCl3溶液中的Cl-,消耗相同浓度的AgNO3的体积比为1:1:1,则原NaCl、MgCl2、AlCl3溶液的物质的量浓度之比为
A. 1:1:1 B. 1:2:3 C. 6:3:2 D. 9:3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】180℃时将0.5 mol H2和1 mol CO2通入1 L的恒容密闭容器中,反应生成甲醇蒸汽(CH3OH)和某无机副产物,测得各物质的物质的量随时间的部分变化如图所示,下列说法中正确的是

A. 该反应的化学方程式:2CO2+4H2![]() 2CH3OH+O2
2CH3OH+O2
B. 在0~3 min内H2的平均化学反应速率为0.1 mol·L-1·min-1
C. 当容器内混合气体密度不再变化时,表明反应已经达到平衡状态
D. 在3~10 min内,反应仍未达到平衡状态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com