
【题目】氨基甲酸铵发生分解的化学方程式为NH2COONH4(s)![]() 2NH3(g) + CO2(g)。利用如下装置测定不同温度下该反应以分压表示的化学平衡常数Kp,实验步骤如下:
2NH3(g) + CO2(g)。利用如下装置测定不同温度下该反应以分压表示的化学平衡常数Kp,实验步骤如下:
(Ⅰ)关闭K3,打开K1和K2,开启真空泵抽气至测压仪数值稳定后关闭K1;
(Ⅱ)关闭K2,缓慢开启K3至U型管两边液面相平并保持不变,读取压强数值。记录25℃、30℃下压强分别为12.0 kPa、17.1 kPa。下列说法错误的是
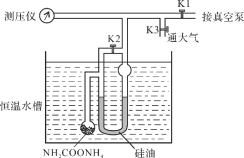
A.氨基甲酸铵分解反应的ΔH>0
B.该反应25℃时的化学平衡常数Kp = 2.56×1011 Pa3
C.步骤Ⅰ中测压仪数值未稳定即关闭K1,Kp测量值偏小
D.步骤Ⅱ中读数时U型管左侧液面偏高,Kp测量值偏小
科目:高中化学 来源: 题型:
【题目】如图中,甲是电解饱和食盐水,乙是铜的电解精炼,丙是电镀,回答:

(1)b极上的电极反应式为__,甲电池的总反应化学方程式是__。
(2)在粗铜的电解过程中,图中c电极的材料是__(填“粗铜板”或“纯铜板”);在d电极上发生的电极反应为__;若粗铜中还含有Au、Ag、Fe等杂质,则沉积在电解槽底部(阳极泥)的杂质是__,电解一段时间后,电解液中的金属离子有__。
(3)如果要在铁制品上镀镍(二价金属,相对原子质量59),则f电极的材料是__(填“铁制品”或“镍块”,下同),e电极的材料是__。
(4)若e电极的质量变化118 g,则a电极上产生的气体在标准状况下的体积为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)25 ℃下,0.1mol/L氨水的电离度为1%,则此温下,该溶液的pH=______。
(2)25 ℃下,pH=2的硫酸溶液Va mL与pH=10的NaOH溶液Vb mL恰好中和,则,Va:Vb=___________。
(3)某温下,水的离子积常数KW=1.0×10-13。该温下,0.2mol·L-1的NaHSO4溶液与0.2mol·L-1的Ba(OH)2溶液等体积混合,混合后溶液的pH=______。
(4)一定条件下,可逆反应A2(g)+B2(g)2AB(g)达到化学平衡,经测定平衡时c(A2)=0.5 mol·L-1,c(B2)=0.1 mol.L-1,c(AB)=1.4 mol·L-1,若A2、B2、AB的起始浓度分别以a、b、c表示。请回答:
①a、b应满足的关系是_________。
②a的取值范围是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或有关化学用语的表达不正确的是
A. 在基态多电子原子中,p轨道电子能量不一定高于s轨道电子能量
B. 核外电子排布由1s22s22p63s1→1s22s22p6 的变化需要吸收能量
C. 某元素基态原子的电子排布图![]()
D. Ca2+离子基态电子排布式为1s22s22p63s23p6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将10 mL 0.1 mol·L-1 NaA溶液逐滴加入10 mL 0.1 mol·L-1 HA溶液中,已知HA的电离平衡常数Ka = 1.8×10-4。下列说法正确的是
A.滴加过程中,混合溶液中![]() 始终变小
始终变小
B.滴加过程中,混合溶液中c(H+) + c(OH-) > 2.0×10-7 mol·L-1
C.充分混合后,溶液中A-的水解程度比原NaA溶液中A-的水解程度大
D.充分混合后,溶液中c(Na+) > c(A-) > c(HA) > c(H+) > c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.若要完全沉淀相同体积的NaCl、MgCl2、AlCl3溶液中的Cl-,消耗相同浓度的AgNO3的体积比为1:1:1,则原NaCl、MgCl2、AlCl3溶液的物质的量浓度之比为
A. 1:1:1 B. 1:2:3 C. 6:3:2 D. 9:3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探索氮氧化合物反应的特征及机理,对处理该类化合物的污染问题具有重要意义。回答下列问题:
(1)工业上利用Na2CO3溶液吸收NO、NO2混合气制备NaNO2,该反应可实现NO和NO2的完全转化,反应的化学方程式为________。
(2)NO2可发生二聚反应生成N2O4,化学方程式为![]() ,上述反应达到平衡后,升高温度可使体系颜色加深,则该反应的
,上述反应达到平衡后,升高温度可使体系颜色加深,则该反应的![]() ________0(填>或<)。已知该反应的正反应速率方程为υ正= k正·c2(NO2),逆反应速率方程为υ逆=k逆·c(N2O4),其中k正、k逆分别为正、逆反应的速率常数。则图(lgk表示速率常数的对数;
________0(填>或<)。已知该反应的正反应速率方程为υ正= k正·c2(NO2),逆反应速率方程为υ逆=k逆·c(N2O4),其中k正、k逆分别为正、逆反应的速率常数。则图(lgk表示速率常数的对数; ![]() 表示温度的倒数)所示①、②、③、④四条斜线中,能表示lgk正随变化关系的是斜线________,能表示lgk逆随
表示温度的倒数)所示①、②、③、④四条斜线中,能表示lgk正随变化关系的是斜线________,能表示lgk逆随![]() 变化关系的是斜线________。
变化关系的是斜线________。
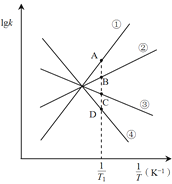
(3)图中A、B、C、D点的纵坐标分别为a + 1.5、a+0.5、a-0.5、a-1.5,则温度T1时化学平衡常数K=_______mol-1·L。已知温度T1时,某时刻恒容密闭容器中NO2、N2O4浓度均为0.2 mol·L-1,此时υ正________υ逆(填>或<);上述反应达到平衡后,继续通入一定量的NO2,则NO2的平衡转化率将________,NO2的平衡浓度将________(填增大、减小或不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积恒定的密闭容器中发生可逆反应A(g)+3B(g) ![]() 2C(g),下列叙述一定是达到平衡的标志的是
2C(g),下列叙述一定是达到平衡的标志的是
①2υ(B)正=3υ(C)逆;②单位时间内生成a mol A,同时消耗2a mol C;③A、B、C的浓度不再变化;④混合气体的总压强不再变化;⑤C的质量分数不再改变;⑥用A、B、C的物质的量浓度变化表示的反应速率之比为1:3:2的状态;⑦A、B、C的浓度彼此相等;⑧混合气体的密度不再改变的状态
A. ①③④⑤ B. ①④⑤⑦ C. ④⑤⑥⑧ D. ③⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25 ℃时,CH3COOH和NH3·H2O的电离常数相等。
(1)25 ℃时,取10 mL 0.1 mol·L-1醋酸溶液测得其pH=3。
①将上述(1)溶液加水稀释至1 000 mL,溶液pH数值范围为___________,溶液中c(CH3COO-)/[c(CH3COOH)·c(OH-)]___________(填“增大”“减小”“不变”或“不能确定”)。
②25 ℃时,0.1 mol·L-1氨水(NH3·H2O溶液)的pH=___________。用pH试纸测定该氨水pH的操作方法为_______________________________________________________。
③氨水(NH3·H2O溶液)电离平衡常数表达式Kb=_______________________________,25 ℃时,氨水电离平衡常数约为___________。
(2)25 ℃时,现向10 mL 0.1 mol·L-1氨水中滴加相同浓度的CH3COOH溶液,在滴加过程中c(NH4+)/c(NH3.H2O)___________(填序号)。
a.始终减小 b.始终增大 c.先减小再增大 d.先增大后减小
(3)某温度下,向V1mL 0.1 mol·L-1NaOH溶液中逐滴加入等浓度的醋酸溶液,溶液中pOH与pH的变化关系如图。已知:pOH=- lgc(OH-)。

图中M、Q、N三点所示溶液呈中性的点是___________(填字母,下同)。
图中M、Q、N三点所示溶液中水的电离程度最大的点可能是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com