
(9分)下图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:

(1)该浓盐酸的物质的量浓度为___________mol/L。
(2)某学生欲用上述浓盐酸和蒸馏水配制250 mL物质的量浓度为0.7 mol/L稀盐酸。
①该学生用量筒量取________ mL上述浓盐酸进行配制;
②所需的实验仪器有:①胶头滴管、②烧杯、③量筒、④玻璃棒,配制稀盐酸时,还缺少的仪器有 。
③下列操作导致所配制的稀盐酸的物质的量浓度偏低的是 (填字母)。
A、用量筒量取浓盐酸时俯视凹液面
B、未恢复到室温就将溶液注入容量瓶并进行定容
C、容量瓶用蒸馏水洗后未干燥
D、定容时仰视液面
E、未洗涤烧杯和玻璃棒
(3)若在标准状况下,将a L HCl气体溶于1 L水中,所得溶液密度为d g/mL,则此溶液的物质的量浓度为 mol/L。
a. b.
b. c.
c. d.
d.
(9分)(1)12(2分);
(2)① 14.6(2分);② 250 mL容量瓶(1分);③ A、D、E(2分,没选全1分,选错不给分);
(3)d(2分)
【解析】
试题分析:(1)根据物质的量浓度与质量分数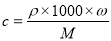 的换算关系可知:
的换算关系可知: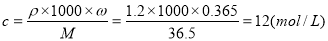 ;(2)①溶液在稀释前后溶质的物质的量不变,所以根据稀释公式C1V1=C2V2可知要配制250 mL物质的量浓度为0.7 mol/L稀盐酸,需要12mol/L的浓盐酸的体积是(250 mL×0.7 mol/L)÷12mol/L=14.6ml。②所需的实验仪器有:①胶头滴管、②烧杯、③量筒、④玻璃棒,配制稀盐酸时,还缺少的仪器有250 mL容量瓶;③A、用量筒量取浓盐酸时俯视凹液面,则盐酸的体积偏小,使配制的溶液的浓度偏低,正确;B、未恢复到室温就将溶液注入容量瓶并进行定容,则等恢复至室温时溶液的体积小于250 mL,使配制的溶液的浓度偏高,错误;C、容量瓶用蒸馏水洗后未干燥,则只要加入水至刻度线即可,因此不会产生任何影响,错误;D、定容时仰视液面,则溶液的体积偏大,使所配溶液的浓度偏低,正确;E、未洗涤烧杯和玻璃棒,则会使一部分溶质残留在容器上,容量瓶中的溶质的物质的量偏少,则使所配溶液的浓度偏低,正确。故选项是A、D、E。(3)a L标准状况下HCl气体的物质的量是a/22.4mol,质量是m(HCll)=(a/22.4)mol×36.5g/mol=(36.5a/22.4)g,溶液的质量是m(溶液)= =[(36.5a/22.4)+1000]g,溶液中溶质的质量分数是:(36.5a/22.4)/ [(36.5a/22.4)+1000]。在根据溶质的质量分数与溶液的物质的量浓度关系式可得
;(2)①溶液在稀释前后溶质的物质的量不变,所以根据稀释公式C1V1=C2V2可知要配制250 mL物质的量浓度为0.7 mol/L稀盐酸,需要12mol/L的浓盐酸的体积是(250 mL×0.7 mol/L)÷12mol/L=14.6ml。②所需的实验仪器有:①胶头滴管、②烧杯、③量筒、④玻璃棒,配制稀盐酸时,还缺少的仪器有250 mL容量瓶;③A、用量筒量取浓盐酸时俯视凹液面,则盐酸的体积偏小,使配制的溶液的浓度偏低,正确;B、未恢复到室温就将溶液注入容量瓶并进行定容,则等恢复至室温时溶液的体积小于250 mL,使配制的溶液的浓度偏高,错误;C、容量瓶用蒸馏水洗后未干燥,则只要加入水至刻度线即可,因此不会产生任何影响,错误;D、定容时仰视液面,则溶液的体积偏大,使所配溶液的浓度偏低,正确;E、未洗涤烧杯和玻璃棒,则会使一部分溶质残留在容器上,容量瓶中的溶质的物质的量偏少,则使所配溶液的浓度偏低,正确。故选项是A、D、E。(3)a L标准状况下HCl气体的物质的量是a/22.4mol,质量是m(HCll)=(a/22.4)mol×36.5g/mol=(36.5a/22.4)g,溶液的质量是m(溶液)= =[(36.5a/22.4)+1000]g,溶液中溶质的质量分数是:(36.5a/22.4)/ [(36.5a/22.4)+1000]。在根据溶质的质量分数与溶液的物质的量浓度关系式可得
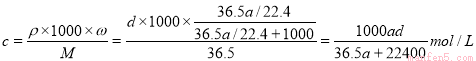 ,所以选项是d
,所以选项是d
考点:考查物质的量浓度的溶液的配制、溶液的质量分数与溶液的物质的量浓度的换算的知识。
考点分析: 考点1:化学计算 考点2:化学用语及其规律 试题属性

科目:高中化学 来源:2014-2015学年湖南省长望浏宁四县高三一模考试化学试卷(解析版) 题型:实验题
【化学—选修2化学与技术】(15分)
氯化亚铜(CuCl)是白色粉末,微溶于水,不溶于乙醇,在空气中会被迅速氧化成绿色碱式盐。从酸性电镀废液(主要含Cu2+、Fe3+)中制备氯化亚铜的工艺流程图如下:
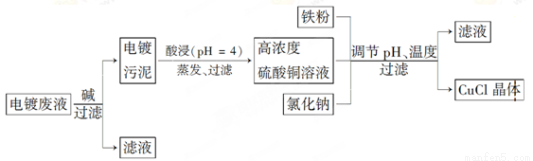
金属离子含量与混合液pH、CuCl产率与混合液pH的关系图如图。
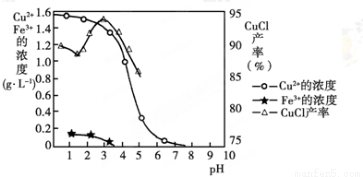
【已知:金属离子浓度为1 mol·L-1时,Fe(OH)3开始沉淀和沉淀完全的pH分别为1.4和3.0,Cu(OH)2开始沉淀和沉淀完全的pH分别为4.2和6.7】
请回答下列问题:
(1)酸浸时发生反应的离子方程式是________;析出CuCl晶体时的最佳pH在_______左右。
(2)铁粉、氯化钠、硫酸铜在溶液中反应生成CuCl的离子反应方程式为________________。
(3)析出的CuCl晶体要立即用无水乙醇洗涤,在真空干燥机内于70℃干燥2 h、冷却密封包装。70℃真空干燥、密封包装的目的是_____________________________________。
(4)产品滤出时所得滤液的主要分成是________,若想从滤液中获取FeSO4·7H2O晶体,还需要知道的是__________________。
(5)若将铁粉换成亚硫酸钠也可得到氯化亚铜,试写出该反应的化学方程式:______________。为提高CuCl的产率,常在该反应体系中加入稀碱溶液,调节pH至3.5。这样做的目的是_____________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省绥化市高三下学期开学联考化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.64g SO2含有氧原子数为NA
B.0.5mol/L MgCl2溶液,含有Cl-离子数为NA
C.标准状况下,22.4L H2O的分子数为NA
D.常温常压下,14g N2含有分子数为0.5NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省漳州市高三3月质量检查化学试卷(解析版) 题型:选择题
常温下,下列各组离子能常量共存的是 、
A.Mg2+、K+、SO42—、NO3— B.Fe2+、H+、Cl—、NO3—
C.Cu2+、Na+、OH—、Cl— D.K+、HCO3—、Ca2+、OH—
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省漳州市高三3月质量检查化学试卷(解析版) 题型:选择题
化学与人类生产、生活、社会可持续发展密切相关。下列说法正确的是
A.稀的食盐水能杀死H7N9禽流感病毒
B.煤经过分馏和干馏两个物理变化,可变为清洁能源
C.电镀厂的废水直接用来灌溉农田,可提高水的利用率
D.用CO2合成聚碳酸酯可降解塑料,有利于减少白色污染
查看答案和解析>>
科目:高中化学 来源:2014-2015四川省资阳市高一上学期学期期末化学试卷(解析版) 题型:选择题
下列说法中正确的是
A.摩尔是化学上常用的一个物理量
B.0.5 mol Na2CO3中含有的Na+的数目是3.01×1023
C.瓦斯中甲烷与氧气的质量比为1∶4时极易爆炸,此时其体积比(相同条件下)为1∶2
D.相同质量的铝粉,分别放入足量的盐酸和氢氧化钠溶液中,放出的氢气在同温同压下的体积之比是1∶3
查看答案和解析>>
科目:高中化学 来源:2014-2015四川省资阳市高一上学期学期期末化学试卷(解析版) 题型:选择题
下列由相关实验现象所推出的结论正确的是
A.向某溶液中加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,则该溶液一定含有SO42-
B.向某溶液中加入CCl4,CCl4层显紫色,证明原溶液中存在I2
C.向某溶液中加入稀盐酸,产生的气体能使澄清石灰水变浑浊,则溶液中一定含有CO32-
D.向一定浓度的Na2SiO3溶液中通入适量CO2气体,出现白色沉淀,说明H2SiO3的酸性强于H2CO3
查看答案和解析>>
科目:高中化学 来源:2014-2015四川省资阳市高二上学期学期期末化学试卷(解析版) 题型:填空题
(6分)(1)石墨是层状结构,如下图所示。每一层内的碳原子间通过sp2杂化形成 (填代号字母,后同);层与层间存在 ;石墨的每一个碳原子经过sp2杂化后,还剩下1个未成对电子,在电场作用下能够作定向移动,因而石墨还具有导电性,所以还存在 。

a:σ键
b:π键
c:氢键
d:配位键
e:范德华力
f:金属键
g:离子键
(2)请选“>”、“<”或“=”填与下列空格中:
①熔点:Na Mg; ②硬度:金刚石 晶体硅; ③晶格能:NaI NaBr
查看答案和解析>>
科目:高中化学 来源:2014-2015上海市高一上学期期末考试化学试卷(解析版) 题型:选择题
反应A+B→C分两步进行:①A+B→X;②X→C。反应过程中能量变化如图所示。下列有关叙述正确的是

A.E2表示反应X→C的反应热
B.A+B→C此反应放热
C.X是反应A+B→C的催化剂
D.加入催化剂可改变反应A+B→C的反应热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com