
【题目】氧是地壳中含量最多的元素。下列含氧物质中,氧元素化合价最高的是( )
A. H2O B. O3 C. H2O2 D. HClO
科目:高中化学 来源: 题型:
【题目】下列除杂质的操作中不正确的是
A. CaO 固体中混有少量CaCO3:高温加热固体至质量恒定
B. NaCl溶液中混有少量Na2CO3:往该溶液中滴加稀盐酸至溶液为中性
C. CO2中混有HCl:将其通过装NaOH溶液的洗气瓶
D. NaCl溶液中混有少量I2:加入适量苯 ,振荡,静置,分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄糖是一种单糖的主要原因是( )
A. 糖类中含碳原子数量最少 B. 不能再水解成更简单的糖
C. 分子中只有一个醛基 D. 糖类中结构最简单
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,可逆反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),平衡时X、Y、Z的浓度分别为0.1molL﹣1、0.3molL﹣1、0.08molL﹣1,则下列判断不合理的是( )
2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),平衡时X、Y、Z的浓度分别为0.1molL﹣1、0.3molL﹣1、0.08molL﹣1,则下列判断不合理的是( )
A、c1:c2=1:3 B、平衡时,Y与Z的生成速率之比为3:2
C、X、Y的转化率不相等 D、c1的取值范围0<c1<0.14 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某矿泉水标签上的部分内容为,钙≥4.0mg/L,钾≥0.35mg/L,镁≥0.5mg/L,钠≥0.8mg/L。标签中的钙、钾、镁、钠指的是
A.原子 B.单质 C.元素 D.分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,因此具有输氧能力,CO吸入肺中发生反应:CO+HbO![]() O2+HbCO,37℃时,该反应的平衡常数K=220。HbCO的浓度达到浓度的0.02倍,会使人智力受损。据此,下列结论错误的是( )
O2+HbCO,37℃时,该反应的平衡常数K=220。HbCO的浓度达到浓度的0.02倍,会使人智力受损。据此,下列结论错误的是( )
A.CO与 HbO2反应的平衡常数K=![]()
B.人体吸入的CO越多,与血红蛋白结合的O2越少
C.当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损
D.把CO中毐的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】O3也是一种很好的消毒剂,具有高效、洁净、方便、经济等优点。O3可溶于水,在水中易分解,产生的[O]为游离氧原子,有很强的杀毒消毒能力。常温常压下发生反应如下:反应①O3![]() O2+[O]△H>0 平衡常数为K1;反应②[O]+O3
O2+[O]△H>0 平衡常数为K1;反应②[O]+O3![]() 2O2△H<0 平衡常数为K2;总反应:2O3
2O2△H<0 平衡常数为K2;总反应:2O3![]() 3O2△H<0 平衡常数为K。下列叙述正确的是( )
3O2△H<0 平衡常数为K。下列叙述正确的是( )
A、升高温度,K增大 B、K=K1+K2
C、压强增大,K2减小 D、适当升温,可提高消毒效率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬及其化合物工业用途广泛,但含+6价铬的污水会损害环境。电镀厂产生的镀铜废水中往往含有一定量的Cr2O72-,处理该废水常用直接沉淀法、还原沉淀法、电解法。
I.直接沉淀法
(1)已知含铬废水中存在着平衡:![]() 。在实际工业生产中,加入沉淀剂BaCl2溶液之前还要加入一定量的NaOH,这样有利于沉淀的生成,则生成沉淀的化学式为
。在实际工业生产中,加入沉淀剂BaCl2溶液之前还要加入一定量的NaOH,这样有利于沉淀的生成,则生成沉淀的化学式为
Ⅱ.还原沉淀法
![]()
(2)下列溶液中可以代替上述流程中Na2S2O3溶液的是 (填选项序号)
A.FeSO4溶液 B.浓H2SO4溶液
C.酸性KMnO4溶液 D.Na2SO3溶液
(3)上述流程中,每消耗0.1molNa2S2O3转移0.8mole-,则加入Na2S2O3溶液时发送反应的离子方程式为
(4)Cr(OH)3的化学性质与Al(OH)3相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,原因可用离子方程式表示:
(5)实际工业生产中有时还采用阳离子交换树脂法来测定沉淀后溶液中Cr3+的含量,其原理是Mn++nNaR=nNa++MRn,其中NaR为阳离子交换树脂,Mn+为要测定的离子。
常温下,某次测定过程中,将pH=5的废水经过阳离子交换树脂后,测的溶液中Na+比交换前增加了4.6×10-2g/L,则该条件下Cr(OH)3的Ksp的值为 ,当Cr3+浓度小于10-5mol/L时可认为沉淀完全,处理后测得溶液的PH=6,则溶液过滤后 (填“能”或“否”)直接排放
Ⅲ.电解法
(6)该法是用铁作电极点解含Cr2O72-的酸性废水,电解时阴极上有大量气泡生成,并产生Cr(OH)3、Fe(OH)3沉淀,反应中1mol Cr2O72-完全生成Cr(OH)3沉淀,外电路通过的电子的物质的量为 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)甲醇(CH3OH)是重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备CH3OH的反应为:CO(g)+2H2(g)![]() CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图一所示。
CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图一所示。
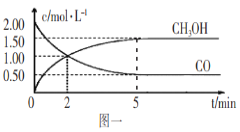
①从反应开始到l0min,用一氧化碳表示的平均反应速率v(CO)=____________。
②下列说法正确的是____________(填字母序号)。
A.达到平衡时,H2的转化率为65%
B.5min后容器中混合气体的平均相对分子质量不再改变
C.达到平衡后,再充入氩气,反应速率减小
D.2min前v(正)>v(逆),2min后v(正)<v(逆)
(2)碳与水蒸气反应制取H2的相关反应如下:
Ⅰ:C(s)+H2O(g)=CO(g)+H2(g) △H=+131.0kJ/mol
Ⅱ:CO(g)+H2O(g)=CO2(g)+H2(g) △H= - 43kJ/mol
Ⅲ:CaO(s)+CO2(g)=CaCO3(S) △H= - 178.3kJ/mol
计算反应C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g)的△H=__________kJ/mol;
CaCO3(s)+2H2(g)的△H=__________kJ/mol;
若K1、K2、K3分别为反应Ⅰ、Ⅱ、Ⅲ的平衡常数,该平衡常数K=__________(用K1、K2、K3表示)。
②对于可逆反应C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是________。(填字母)
CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是________。(填字母)
A.降低体系的温度 B.压缩容器的体积
C.增加CaO的量 D.选用适当的催化剂
(3)甲醇作为一种燃料还可用于燃料电池。在温度为650℃的熔融盐燃料电池中用甲醇、空气与CO2的混合气体作反应物,镍作电极,用Li2CO3和Na2CO3混合物作电解质。该电池的负极反应式为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com