
(13分)硫代硫酸钠是一种常见的化工原料。将SO2通入按一定比例配成的Na2S和Na2CO3的混合溶液中,便可得到Na2S2O3,其制备反应方程式为:
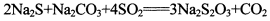 o
o
(1) 在配制混合溶液前先将蒸馏水加热煮沸一段时间后待用,其目的是_______。
(2) 用该方法获得的Naj2O3^H2O晶体中常混有一定量的杂质。某兴趣小组欲对其中所含杂质成分进行探究(不考虑副反应和杂质所带的结晶水)。
假设1 :晶体中只含>fe2C03杂质
假设2:晶体中只含Na2S杂质
假设3: ____________________________
②NhS2O3在中性、碱性溶液中较稳定,而在酸性溶液中能迅速反应:
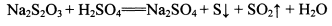
【判断与思考】
某同学取少量制得的晶体溶于足量稀H2SO4,并将产生的气体通入CuSO4溶液中,未见黑色沉淀,据此认为假设2不成立。你认为其结论是否合理?_______ (填“合理”、“不合理”)并说明理由:____________________________
基于假设1,完成下表实验方案、现象及结论(仪器自选)。
限选实验试剂: 酸性KMnO4溶液、饱和NaHCO3溶液、品红溶液、澄清石灰水
酸性KMnO4溶液、饱和NaHCO3溶液、品红溶液、澄清石灰水

(3) 已知: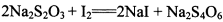 。为测定所制得晶体的纯度,该小组以淀粉作指示剂,用
。为测定所制得晶体的纯度,该小组以淀粉作指示剂,用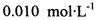 的碘水进行多次取样滴定,测得
的碘水进行多次取样滴定,测得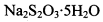 的含量约为102%。若所用试剂及操作均无不当,产生该结果最可能的原因是______________。
的含量约为102%。若所用试剂及操作均无不当,产生该结果最可能的原因是______________。
(1)赶走水中的溶解氧(或空气) (2分)
(2)晶体中含Na2S和Na2CO3两种杂质(2分)
不合理;(1分) Na2S2O3与稀H2SO4反应生成的SO2和H2S发生反应,可能无H2S逸出。(2分)
|
实验方案 |
现象及结论 |
|
取适量晶体于烧瓶中,加入足量3 mol∙L-1 H2SO4,塞上带导气管的橡皮塞,将产生的气体导出并依次通过盛有酸性KMnO4溶液、品红溶液、澄清石灰水的洗气瓶。(2分) |
品红溶液不褪色、澄清石灰水变浑浊,晶体中含Na2CO3杂质(2分) |
(其他合理答案均给分)
(3)晶体中含有杂质(如Na2S等)在滴定时参与反应或晶体部分失去结晶水(2分)(其他合理答案均给分)
【解析】晶体的主体Na2S2O3·5H2O与稀H2SO4反应生成的SO2对H2S和CO2的检验都有干扰,在检验时应充分考虑;考虑到晶体中含有的杂质(Na2S)在滴定时参与反应,是解答第(3)小题的关键。


科目:高中化学 来源: 题型:
①在1.520 g样品中加入碳酸氢钾溶液、0.13% I2的氯仿溶液,在分液漏斗中振荡15 min。离子方程式为:![]() +I2+2
+I2+2![]() ====
====![]() +2I-+2CO2↑+H2O
+2I-+2CO2↑+H2O
②取①中所得的水溶液,加入一定量乙酸、足量的饱和溴水溶液,充分振荡,其中碘离子被氧化成碘酸根离子,得到250 mL溶液。
③在②所得溶液中取25 mL,滴加甲酸,除去其中过量的Br2。
方程式为:Br2+HCOOH====2HBr+CO2↑
④将③所得溶液中加适量的醋酸钠,再加入足量的碘化钾溶液,振荡溶液。
⑤用标准的硫代硫酸钠溶液滴定④中所得溶液,共消耗0.1120 mol·L-1 Na2S2O3 15.10 mL。离子方程式为:I2+2![]() ====2I-+
====2I-+![]()
回答下列问题:
(1)写出②④两步操作中所发生反应的离子方程式。
(2)①中为什么要用0.13% I2的氯仿溶液,而不直接用I2的水溶液?
(3)计算样品中亚硫酸钠的质量分数。
查看答案和解析>>
科目:高中化学 来源: 题型:
(13分)硫代硫酸钠是一种常见的化工原料。将SO2通入按一定比例配成的Na2S和Na2CO3的混合溶液中,便可得到Na2S2O3,其制备反应方程式为:
o
(1) 在配制混合溶液前先将蒸馏水加热煮沸一段时间后待用,其目的是_______。
(2) 用该方法获得的Naj2O3^H2O晶体中常混有一定量的杂质。某兴趣小组欲对其中所含杂质成分进行探究(不考虑副反应和杂质所带的结晶水)。
【提出假设】
假设1 :晶体中只含>fe2C03杂质
假设2:晶体中只含Na2S杂质
假设3: ____________________________
【查阅资料】
②NhS2O3在中性、碱性溶液中较稳定,而在酸性溶液中能迅速反应:
【判断与思考】
某同学取少量制得的晶体溶于足量稀H2SO4,并将产生的气体通入CuSO4溶液中,未见黑色沉淀,据此认为假设2不成立。你认为其结论是否合理?_______ (填“合理”、“不合理”)并说明理由:____________________________
【设计方案进行实验】
基于假设1,完成下表实验方案、现象及结论(仪器自选)。
限选实验试剂:酸性KMnO4溶液、饱和NaHCO3溶液、品红溶液、澄清石灰水
(3) 已知:。为测定所制得晶体的纯度,该小组以淀粉作指示剂,用
的碘水进行多次取样滴定,测得
的含量约为102%。若所用试剂及操作均无不当,产生该结果最可能的原因是______________。
查看答案和解析>>
科目:高中化学 来源:2012届安徽省江南十校高三素质教育联考理科综合试卷化学部分(解析版) 题型:填空题
(13分)硫代硫酸钠是一种常见的化工原料。将SO2通入按一定比例配成的Na2S和Na2CO3的混合溶液中,便可得到Na2S2O3,其制备反应方程式为: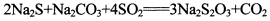 o
o
(1) 在配制混合溶液前先将蒸馏水加热煮沸一段时间后待用,其目的是_______。
(2) 用该方法获得的Naj2O3^H2O晶体中常混有一定量的杂质。某兴趣小组欲对其中所含杂质成分进行探究(不考虑副反应和杂质所带的结晶水)。
【提出假设】
假设1 :晶体中只含>fe2C03杂质
假设2:晶体中只含Na2S杂质
假设3: ____________________________
【查阅资料】
②NhS2O3在中性、碱性溶液中较稳定,而在酸性溶液中能迅速反应: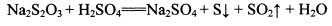
【判断与思考】
某同学取少量制得的晶体溶于足量稀H2SO4,并将产生的气体通入CuSO4溶液中,未见黑色沉淀,据此认为假设2不成立。你认为其结论是否合理?_______ (填“合理”、“不合理”)并说明理由:____________________________
【设计方案进行实验】
基于假设1,完成下表实验方案、现象及结论(仪器自选)。
限选实验试剂: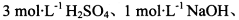 酸性KMnO4溶液、饱和NaHCO3溶液、品红溶液、澄清石灰水
酸性KMnO4溶液、饱和NaHCO3溶液、品红溶液、澄清石灰水
(3) 已知: 。为测定所制得晶体的纯度,该小组以淀粉作指示剂,用
。为测定所制得晶体的纯度,该小组以淀粉作指示剂,用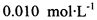 的碘水进行多次取样滴定,测得
的碘水进行多次取样滴定,测得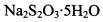 的含量约为102%。若所用试剂及操作均无不当,产生该结果最可能的原因是______________。
的含量约为102%。若所用试剂及操作均无不当,产生该结果最可能的原因是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)实验室定量分析某样品中亚硫酸钠的一种方法是:
①在1.520g样品中加入碳酸氢钾溶液、0.13% I2的氯仿溶液,在分液漏斗中振荡15min。离子方程式为:SO32-+I2+2HCO3-=SO42-+2I-+2CO2↑+H2O
②取①中所得的水溶液,加入一定量乙酸、足量的饱和溴水溶液,充分振荡,其中碘离子被氧化成碘酸根离子,得到250mL溶液。
③在②所得溶液中取25mL,滴加甲酸,除去其中过量的Br2。
④将③所得溶液中加适量的醋酸钠,再加入足量的碘化钾溶液,振荡溶液。离子方程式为:6H++IO3-+5I-=3I2+3H2O
⑤用标准的硫代硫酸钠溶液滴定④中所得溶液,共消耗0.1120mol/L Na2S2O3 15.10mL。离子方程式为:I2+252O32-=2I-+S4O62-
回答下列问题:
(1)写出②、③三步操作中所发生反应的离子方程式。
(2)①中为什么要用0.13% I2的氯访溶液,而不直接用I2的水溶液?
(3)计算样品中亚硫酸钠的质量百分含量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com