
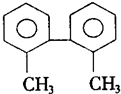
| A. | 分子中至少有8个碳原子处于同一平面上 | |
| B. | 分子中至少有9个碳原子处于同一平面上 | |
| C. | 该烃的一氯取代物最多有8种 | |
| D. | 分子中至少有6个碳原子处于同一直线上 |
分析 有机物结构对称,苯环上有4种等效氢原子,苯环为平面结构,与苯环直接相连的碳原子可在同一个平面上,以此解答该题.
解答 解:苯环为平面结构,与苯环直接相连的碳原子可在同一个平面上,另一苯环的碳原子对角线也可与苯环在同一个平面上,则至少有9个碳原子在同一个平面上,
每个苯环上4个H各不相同,取代苯环上的H有4种异构体,再加上甲基被取代,则该烃的一氯取代物最多有5种,
含有两个苯环,处于对角线的碳原子可能在一条直线上,则分子中有4个碳原子可能处于同一直线上.
故选B.
点评 本题考查有机物的结构和性质,侧重于有机物知识的综合考查,注意把握有机物的结构特点以及同分异构体的判断,为该题的难点,也是易错点,题目难度不大.


科目:高中化学 来源: 题型:选择题
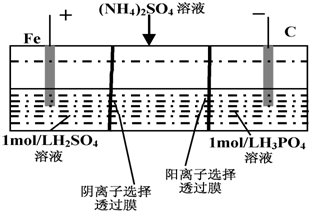
| A. | 阳极室溶液由无色变成棕黄色 | |
| B. | 阴极的电极反应式为:4OH--4e-=2H2O+O2↑ | |
| C. | 电解一段时间后,阴极室溶液中的酸性减弱 | |
| D. | 电解一段时间后,阴极室溶液中的溶质一定是(NH4)3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 | |
| B. | Na2C2O4溶液:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4) | |
| C. | Na2CO3溶液:c(Na+)=2c(CO32-)+c(HCO3-) | |
| D. | CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)+c(H+)=c(CH3COO-)+c(OH?)+c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液与足量的Ca(HCO3)2溶液反应:2HCO3-+2OH-+Ca2+═CaCO3↓+2H2O | |
| B. | 用铜为电极电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- | |
| C. | FeBr2溶液中通入过量Cl2:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| D. | Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾[KAl(SO4)2•12H2O]在水中能形成Al(OH)3胶体,可用作净水剂 | |
| B. | 金刚石是自然界中硬度最大的物质,不可能与氧气发生反应 | |
| C. | 常温下Fe、Al遇浓HNO3发生钝化,故Fe、Al不能与浓HNO3发生反应 | |
| D. | 将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后加热也能恢复原色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2KNO3+3C+S$\frac{\underline{\;\;△\;\;}}{\;}$K2S+N2↑+3CO2↑ | B. | 2NaCl $\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑ | ||
| C. | 2AgNO3$\frac{\underline{\;\;△\;\;}}{\;}$2Ag+2NO2↑+O2↑ | D. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com