
 .
.分析 A、B、C、D四种短周期元素,它们的核电荷数依次增大.有一种元素的单质易溶于CS2溶剂中,该单质为S,故D为S元素,B 与D是同族元素,则B为O元素,B、D两元素的质子数之和是A、C两元素的质子数之和的两倍,则A、C质子数之和为$\frac{8+16}{2}$=12,则A、C同族,则A为H元素、C为Na.
解答 解:A、B、C、D四种短周期元素,它们的核电荷数依次增大.有一种元素的单质易溶于CS2溶剂中,该单质为S,故D为S元素,B 与D是同族元素,则B为O元素,B、D两元素的质子数之和是A、C两元素的质子数之和的两倍,则A、C质子数之和为$\frac{8+16}{2}$=12,则A、C同族,则A为H元素、C为Na.
(1)A元素的名称为氢,B元素的符号为O,
故答案为:氢;O;
(2)Na与H2O反应的离子方程式:2Na+2H2O=2Na++2OH-+H2↑,
故答案为:2Na+2H2O=2Na++2OH-+H2↑;
(3)A、B、C三种元素形成的化合物为NaOH,用电子式表示形成过程为 ,
,
故答案为: ;
;
(4)两种均含有这四种元素的化合物为NaHSO3、NaHSO4,相互反应的离子方程式:HSO3-+H+=SO2↑+H2O,
故答案为:HSO3-+H+=SO2↑+H2O;
(5)用一个方程式说明氧的非金属性比硫的非金属性强的事实是:2H2S+O2=2S↓+2H2O,
故答案为:2H2S+O2=2S↓+2H2O.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,熟练掌握元素化合物性质,注意用电子式表示化学键或物质的形成.


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 部分卤代烃可用作灭火剂 | |
| B. | 甲醛的水溶液(福尔马林)可用于防腐 | |
| C. | 酚类化合物有毒,不能用于杀菌消毒 | |
| D. | 乙二醇可用于配制汽车防冻液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 114号元素衰变成112号元素是化学变化 | |
| B. | 114号元素位于第12列 | |
| C. | ${\;}_{114}^{263}$X的中子数与质子数之差为149 | |
| D. | 112号元素位于周期表第七周期第ⅡB族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
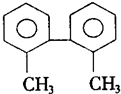
| A. | 分子中至少有8个碳原子处于同一平面上 | |
| B. | 分子中至少有9个碳原子处于同一平面上 | |
| C. | 该烃的一氯取代物最多有8种 | |
| D. | 分子中至少有6个碳原子处于同一直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 暖冰中水分子是一种非常稳定的化合物,这是由于氢键所致 | |
| B. | 暖冰中水分子的各原子均满足8电子稳定结构 | |
| C. | 水凝固形成20℃时的“暖冰”所发生的变化是化学变化 | |
| D. | 在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰” |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和滴定、pH试纸 | B. | 蒸馏、Na2CO3溶液 | ||
| C. | 电解、NaOH溶液 | D. | 酯化反应、石蕊试液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com