
| A. | 暖冰中水分子是一种非常稳定的化合物,这是由于氢键所致 | |
| B. | 暖冰中水分子的各原子均满足8电子稳定结构 | |
| C. | 水凝固形成20℃时的“暖冰”所发生的变化是化学变化 | |
| D. | 在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰” |
分析 A、化合物的稳定性取决于化学键,与氢键无关;
B、分子中原子满足8电子稳定结构的方法是:元素的化合价绝对值+该原子的最外层电子数=8,就达到8电子稳定结构,否则就不满足8电子稳定结构;
C、在反应中有新物质生成的是化学反应;
D、根据题意知,电场作用下,水分子间更易制得“暖冰”.
解答 解:A、氢键是分子间作用力的一种,化合物的稳定性取决于分子内化学键的强弱,与氢键无关,故A错误;
B、水分子中氢原子化合价的绝对值1+氢原子最外层电子数1=2,所以水分子中氢原子不满足8电子稳定结构,故B错误;
C、水凝固形成20℃时的“暖冰”没有新物质生成,所以所发生的变化不是化学变化,故C错误;
D、在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰”,否则20℃时,水分子不能瞬间凝固形成冰,故D正确;
故选D.
点评 本题考查了分子的稳定性影响因素、分子中原子8电子稳定结构的判断、化学变化的判断等知识点,难度不大,注意分子中原子满足8电子稳定结构的方法是:元素的化合价绝对值+该原子的最外层电子数=8,就达到8电子稳定结构,否则就不满足8电子稳定结构.


 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 己烷(己烯) 溴水 分液 | B. | 淀粉溶液(NaCl) 水 过滤 | ||
| C. | CH3CH2OH(CH3COOH) CaO 蒸馏 | D. | CO2(SO2) Na2CO3溶液 洗气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H6 | B. | C2H2 | C. | C3H4 | D. | C4H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 异戊烷的球棍模型: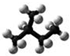 | B. | 乙醇的比例模型: | ||
| C. | 丙烯的结构简式:CH3CHCH2 | D. | 四氯化碳的电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | r(Al)/r(Na) | B. | r(C)/r(Si) | C. | r(F?)/r(Mg2+) | D. | r(Fe2+)/r(Fe) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
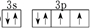
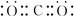
 ,该电子排布图错误的理由是违背了洪特规则.
,该电子排布图错误的理由是违背了洪特规则.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com