
【题目】下列实验操作正确且能达到相应实验目的的是( )
实验目的 | 实验操作 | |
A | NaOH固体 | 先在托盘上各放一张滤纸,然后在右盘上添加2 g砝码,左盘上添加NaOH固体 |
B | 配制FeCl3溶液 | 将FeCl3固体溶于适量蒸馏水 |
C | 检验溶液中是否含NH | 取少量试液于试管中,加入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体 |
D | 验证铁的吸氧腐蚀 | 将铁钉放入试管中,用盐酸浸没 |
A. A B. B C. C D. D
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】.除去粗盐溶液中的Ca2+、Mg2+、SO42- 等杂质,需依次加入稍过量的NaOH溶液、X溶液、Y溶液,过滤,向滤液中滴加稀盐酸调至中性。其中X、Y分别是
A. Na2 CO3 Ba(NO3)2 B. Ba(NO3)2 Na2 CO3
C. Na2 CO3 BaCl2 D. BaCl2 Na2 CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有1 mol KAl(SO4)2的溶液中逐滴加入氢氧化钡溶液,充分反应。下列说法不正确的是
A.当Al3+恰好完全沉淀时,消耗氢氧化钡1.5 mol
B.当![]() 恰好完全沉淀时,铝元素全部以偏铝酸根离子的形式存在
恰好完全沉淀时,铝元素全部以偏铝酸根离子的形式存在
C.当向溶液中加入1.5 mol氢氧化钡时,反应可用下列离子方程式表示:2Al3++3![]() +3Ba2++6OH
+3Ba2++6OH
===2Al(OH)3↓+3BaSO4↓
D.随加入的氢氧化钡的物质的量不断增大,沉淀的物质的量不断增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,铁是使用最广泛的金属之一,已知在高温下,Fe与水蒸气可发生反应。
应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。

请回答下列的问题。
(1)铁在周期表中的位置是_______
(2)请写出该反应的化学方程式: ;
(3)曾利用铝和铁的氧化物反应原理来焊接钢轨,该反应的化学方程式为
(4)现有铁和铂组成的合金共a mol,其中Pt的物质的量分数为x,研成粉末状后全部投入含bmol HNO3的稀溶液中,使其充分反应,且HNO3的还原产物只有NO。试回答下列问题:
①随HNO3用量的增加,溶液中的金属离子和残留固体的成分依次有四种情况,请用粒子符号填写下表空白:
① | ② | ③ | ④ | |
溶液中的金属离子 | Fe2+ | |||
残留固体成分 | Fe、Pt | Pt | Pt |
②当x="0.5" ,且溶液中Fe3+与Fe2+和物质的量相等,在标准状况下共产生112mLNO。
则a = ,b = ,
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤能排放大量的 CO、CO2、SO2,PM2.5(可入肺颗粒物)污染也跟冬季燃煤密切相关。SO2、CO、CO2 也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径。
(1)PM2.5是指大气中直径小于或等于2.5微米的可入肺的有害颗粒,下列有关说法中正确的是(______)
a.PM2.5空气中形成了胶体
b.PM2.5表面积能大面积吸附大量的有毒有害物质
c.机动车尾气排放等过程中经过燃烧而排放的残留物,大多还有重金属等有毒物质
d.研制开发燃料电池汽车,降低机动车尾气污染,某种程度可以减少PM2.5污染
(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
已知:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H=-akJ·mol-1;
CH3OH(g)+H2O(g)△H=-akJ·mol-1;
2H2(g)+O2(g)=2H2O(g) △H=-bkJ·mol-1;
H2O(g)= H2O(l) △H=-ckJ·mol-1;
CH3OH(g)= CH3OH(l) △H=-dkJ·mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为________________________。
(3)工业上还可以通过下列反应制备甲醇:CO(g)+2H2(g) ![]() CH3OH(g)。在一容积可变的密闭容器中充入 10mol CO 和 20mol H2,CO 的平衡转化率随温度(T)、压强(P)的变化如图所示。
CH3OH(g)。在一容积可变的密闭容器中充入 10mol CO 和 20mol H2,CO 的平衡转化率随温度(T)、压强(P)的变化如图所示。

①下列说法不能判断该反应达到化学平衡状态的是_________(填字母)。
a.H2 的消耗速率等于 CH3OH 的生成速率的 2 倍
b.H2 的体积分数不再改变
c.体系中 H2 的转化率和 CO 的转化率相等
d.体系中气体的平均摩尔质量不再改变
②比较 A、B 两点压强大小 PA__________PB(填“>”“<”或“=”)。
③若达到化学平衡状态 A 时,容器的体积为 20 L。如果反应开始时仍充入 10 mol CO 和 20 mol H2,则在平衡状态 B 时容器的体积 V(B)=____L。
(4)SO2 在一定条件下可与氧气构成原电池。下图是利用该电池在铁表面镀铜的装置示意图:

①该电池的负极反应:______________________________;
②当甲中消耗2.24 L O2(标准状况)时,乙中_____(填“a”或“b”)增重_______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛(Ti)是一种具有许多优良性能的的金属,钛和钛合金被认为是21世纪的重要金属材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
①Ti2+基态的电子排布式可表示为_____________________。
②BH![]() 的空间构型是________________________________(用文字描述)。
的空间构型是________________________________(用文字描述)。
③与钛同周期的所有元素的基态原子中,未成对电子数与钛相同的元素有________种。
(2)二氧化钛(TiO2 )是常用的、具有较高催化活性和稳定性的光催化剂,常用于污水处理。
①纳米TiO2催化的一个实例如下图所示。
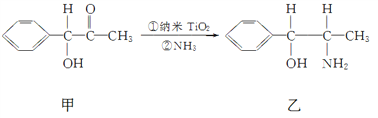
化合物甲的分子中采取sp2杂化方式的碳原子个数为________, 化合物乙中采取sp3杂化的原子的第一电离能由小到大的顺序为____________。
②在 TiO2催化作用下,可将CN- 氧化成CNO- ,进而得到N2 。与CNO- 互为等电子体的分子、离子化学式分别为_____________、_______________(各写一种)。
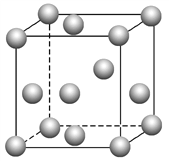
(3)金属钛内部原子的堆积方式与铜相同,都是面心立方堆积方式,如下图。若该晶胞的密度为ρ g·cm-3,阿伏加德罗常数为NA,则该晶胞的边长为________cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有以下三种物质:
A.新制的氢氧化铜[Cu(OH)2]悬浊液 B.晶体硅[Si] C.明矾[KAl(SO4)2·12H2O]
请你根据题意,选择恰当的选项用字母代号填空。
(1)检验物质中是否含有醛基,可使用___;
(2)用于制造太阳能电池的材料,可使用___;
(3)要使含少量泥沙的浑浊水变澄清,可使用___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了避免NO、NO2、N2O4对大气的污染,常采用NaOH溶液进行吸收处理(反应方程式:2NO2+2NaOH===NaNO3+NaNO2+H2O;NO2+NO+2NaOH===2NaNO2+H2O)。现有由a mol NO、b mol NO2、c mol N2O4组成的混合气体恰好被V L NaOH溶液吸收(无气体剩余),则此NaOH溶液的物质的量浓度为
A. ![]() mol·L-1 B.
mol·L-1 B. ![]() mol·L-1
mol·L-1
C. ![]() mol·L-1 D.
mol·L-1 D. ![]() mol·L-1
mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com