
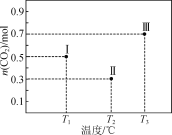
【题目】Ⅰ、Ⅱ、Ⅲ三个容积均为1 L的恒容密闭容器中均投入1 mol CO2和3 mol H2,在不同温度下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。反应10 min,测得各容器内CO2的物质的量分别如右图所示。下列说法正确的是
CH3OH(g)+H2O(g)。反应10 min,测得各容器内CO2的物质的量分别如右图所示。下列说法正确的是
A.该正反应ΔH<0
B.T1时,该反应的平衡常数为![]()
C.10 min内,容器Ⅱ中的平均速率:v(H2)=0.07 mol·L-1·min-1
D.10 min后,向容器Ⅲ中再加入1 mol CO2(g)和1 mol H2O(g),此时v(逆)>v(正)
【答案】AD
【解析】
A. 根据图中信息可知,Ⅰ中反应末达平衡,Ⅱ、Ⅲ反应达平衡,则升高温度,CO2的物质的量增大,平衡逆向移动,证明该正反应ΔH<0,选项A正确;
B. T1时,反应末达平衡状态,无法计算反应的平衡常数,选项B错误;
C. 10 min内,容器Ⅱ中的平均速率:v(H2)=3 v(CO2)=3× =0.21 mol·L-1·min-1,选项C错误;
=0.21 mol·L-1·min-1,选项C错误;
D. 10 min时n(CO2)= 0.7 mol, 则n(H2)=2.1 mol、n(CH3OH)= n(H2O)= 0.3mol,平衡常数K=![]() ,向容器Ⅲ中再加入1 mol CO2(g)和1 mol H2O(g),此时Q=
,向容器Ⅲ中再加入1 mol CO2(g)和1 mol H2O(g),此时Q=![]() >K,反应逆向移动,v(逆)>v(正),选项D正确。
>K,反应逆向移动,v(逆)>v(正),选项D正确。
答案选AD。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极 a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法错误的是( )

A. 电池工作时,正极可发生反应:2Li2S6+2Li++2e-=3Li2S4
B. 电池工作时,外电路中流过 0.02 mol 电子,负极材料减重 0.14 g
C. 石墨烯的作用主要是提高电极a的导电性
D. 电池充电时间越长,电池中Li2S2的量越多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解质的说法正确的是
A.二氧化硫的水溶液能导电,故二氧化硫是电解质
B.![]() 、AgCl在水中溶解度很小,所以是弱电解质
、AgCl在水中溶解度很小,所以是弱电解质
C.电解质溶液通电后才能发生电离
D.向氨水中滴加少量等浓度的醋酸溶液后,溶液导电性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁红(Fe2O3)常用于油漆、油墨及橡胶工业。工业上以一定质量的硫铁矿烧渣(主要成分为Fe2O3、Fe3O4,另含少量难溶杂质)为主要原料制备铁红的一种工艺流程如下:
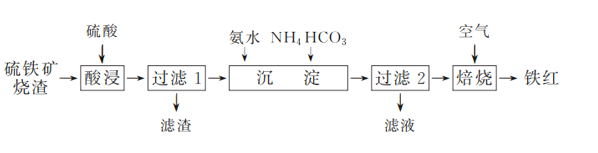
已知:某些过渡元素(如Cu、Fe、Ag等)的离子能与NH3、H2O、OH-、SCN-等形成可溶性配合物。
(1) 工业常将硫铁矿烧渣经过粉碎后再进行“酸浸”,其目的是________。
(2) “酸浸”时加入的硫酸不宜过量太多的原因是________。
(3) “过滤1”所得滤液中含有的阳离子有________。
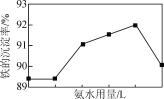
(4) “沉淀”过程中,控制NH4HCO3用量不变,铁的沉淀率随氨水用量变化如右图所示。当氨水用量超过一定体积时,铁的沉淀率下降。其可能的原因是________。
(5) “过滤2”所得滤渣的主要成分为FeOOH和FeCO3,所得滤液中的主要溶质是________(填化学式)。
(6) 写出FeCO3在空气中焙烧生成铁红的化学方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种电解质溶液可以循环流动的新型电池。下列说法正确的是
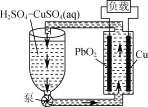
A.Cu电极为正极
B.PbO2电极反应式为PbO2+2e-+4H+=Pb2++2H2O
C.放电后循环液中H2SO4与CuSO4物质的量之比变小
D.若将Cu换成Pb,则电路中电子转移方向改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟铝酸钠(Na3AlF6)是工业炼铝中重要的含氟添加剂。实验室以氟石(CaF2)、石英和纯碱为原料模拟工业制备氟铝酸钠的流程如下:
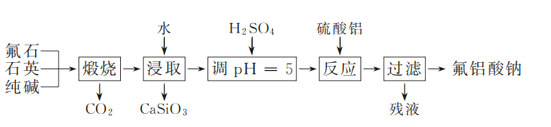
(1) “煅烧”时,固体药品混合后应置于________(填仪器名称)中加热。
(2) 通过控制分液漏斗的活塞可以调节添加液体的速率。调溶液pH接近5时,滴加稀硫酸的分液漏斗的活塞应如下图中的________(填序号)所示。

(3) 在酸性废水中加入Al2(SO4)3、Na2SO4混合溶液,可将废水中F-转换为氟铝酸钠沉淀。
① 该混合溶液中,Al2(SO4)3与Na2SO4的物质的量之比应≥________(填数值)。
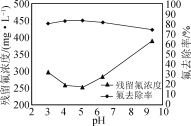
②在不改变其他条件的情况下,加入NaOH调节溶液pH。实验测得溶液中残留氟浓度和氟去除率随溶液pH的变化关系如图所示。pH>5时,溶液中残留氟浓度增大的原因是________。
(4) 若用CaCl2作为沉淀剂除去F-,欲使F-浓度不超过0.95 mg·L-1,c(Ca2+)至少为________mol·L-1。[Ksp(CaF2)=2.7×10-11]
(5) 工业废铝屑(主要成分为铝,少量氧化铁、氧化铝)可用于制取硫酸铝晶体[Al2(SO4)3·18H2O]。
①请补充完整由废铝屑为原料制备硫酸铝晶体的实验方案:取一定量废铝屑,放入烧杯中,____________________________________________________________,得硫酸铝晶体。[已知:pH=5时,Al(OH)3沉淀完全;pH=8.5时,Al(OH)3沉淀开始溶解。须使用的试剂:3 mol·L-1 H2SO4溶液、2 mol·L-1 NaOH溶液、冰水]
②实验操作过程中,应保持强制通风,原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】夹紧下列装置中的弹簧夹并进行相关操作。下列情形中,表明相应装置漏气的是( )
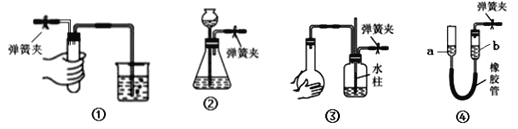
A. 装置①中,用手捂住试管,烧杯中出现气泡,放开手后,导管中形成一段稳定的水柱
B. 装置②中,向长颈漏斗中加入一定量水,形成水柱,随后水柱下降至与瓶中液面相平的位置
C. 装置③中,双手捂住烧瓶,导管中形成一段稳定的水柱,双手放开后,水柱慢慢回落
D. 装置④中,将a管向上提至一段高度,a、b两管之间水面形成稳定的高度差
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下4组实验,如图Ⅰ~Ⅳ所示。
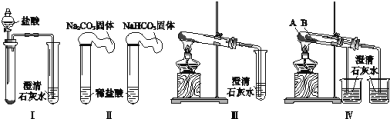
(1)Ⅱ所示的实验,若固体质量相同且稀盐酸足量时,气球鼓起较小的是___(填化学式)。
(2)Ⅲ、Ⅳ所示的实验均能鉴别这两种物质,相关反应的化学方程式是___和___。
(3)与Ⅲ相比,IV的优点是___(填选项序号)。
a.Ⅳ比Ⅲ复杂
b.Ⅳ比Ⅲ安全
c.Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行
(4)若用Ⅳ验证碳酸钠和碳酸氢钠的热稳定性,则试管B中装入的固体应该是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的离子方程式正确的是( )
A. 用小苏打治疗胃酸过多:HCO3-+H+===CO2↑+H2O
B. 往碳酸镁中滴加稀盐酸:CO32-+2H+===CO2↑+H2O
C. 往澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2===CaCO3↓+H2O
D. 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-===BaSO4↓+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com