
【题目】夹紧下列装置中的弹簧夹并进行相关操作。下列情形中,表明相应装置漏气的是( )
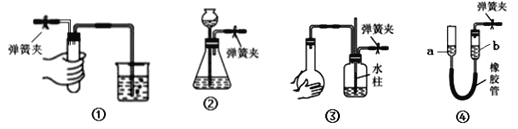
A. 装置①中,用手捂住试管,烧杯中出现气泡,放开手后,导管中形成一段稳定的水柱
B. 装置②中,向长颈漏斗中加入一定量水,形成水柱,随后水柱下降至与瓶中液面相平的位置
C. 装置③中,双手捂住烧瓶,导管中形成一段稳定的水柱,双手放开后,水柱慢慢回落
D. 装置④中,将a管向上提至一段高度,a、b两管之间水面形成稳定的高度差
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是______________________________________。
(2)装置乙中正极的电极反应式是_______________________________________。
(3)装置丙中溶液的pH________(填“变大”、“变小”或“不变”)。
(4)四种金属活动性由强到弱的顺序是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室现需配制物质的量浓度为 1 mol/L 的 NaOH 溶液 480 mL。
(1)配制该溶液的实验步骤包括:
a.计算需要氢氧化钠固体的质量;
b.称量氢氧化钠固体;
c.将烧杯中的溶液注入容量瓶中,洗涤烧杯和玻璃棒,将洗涤液全部转移入容量瓶中;
d.用适量的蒸馏水溶解称量好的氢氧化钠固体,冷却;
e.盖好瓶塞,反复上下颠倒,摇匀;
f.继续向容量瓶中加蒸馏水至刻度线下1~2cm时,改用________滴加蒸馏水至凹液面与刻度线相切。上述步骤的正确操作顺序是________。
(2)使用________mL的容量瓶配制此溶液,需要称量NaOH固体的质量为________g。
(3)下列操作会使所配制溶液浓度偏小的有________。
A 容量瓶中原有少量蒸馏水
B 转移溶液时,没有洗涤玻璃棒和溶解用的烧杯
C 定容摇匀后,静置时发现液面低于刻度线,又加水至刻度线
D 定容时,俯视观察液面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、Ⅱ、Ⅲ三个容积均为1 L的恒容密闭容器中均投入1 mol CO2和3 mol H2,在不同温度下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。反应10 min,测得各容器内CO2的物质的量分别如右图所示。下列说法正确的是
CH3OH(g)+H2O(g)。反应10 min,测得各容器内CO2的物质的量分别如右图所示。下列说法正确的是
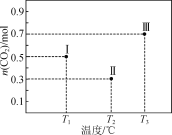
A.该正反应ΔH<0
B.T1时,该反应的平衡常数为![]()
C.10 min内,容器Ⅱ中的平均速率:v(H2)=0.07 mol·L-1·min-1
D.10 min后,向容器Ⅲ中再加入1 mol CO2(g)和1 mol H2O(g),此时v(逆)>v(正)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】检验溶液中是否含有某种离子,下列操作方法正确的是 ( )
A. 某溶液加入稀盐酸产生无色气体,将气体通入澄清石灰水,溶液变浑浊,则一定含有CO32一
B. 某溶液加入氢氧化钠溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝,则一定含有NH4+
C. 某溶液滴入BaCl2溶液,再滴加稀盐酸,产生白色沉淀,则一定含有SO42一
D. 某溶液加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,则一定含有Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由硝酸锰[Mn(NO3)2]制备的一种含锰催化剂,常温下能去除甲醛、氢氰酸(HCN)等有毒气体。
(1) Mn2+基态核外电子排布式是________________。NO3-的空间构型为__________________(用文字描述)
(2) 甲醛分子中,碳原子的杂化方式为________。
(3) HCN分子中σ键与π键的数目比为________。H、C、N三种元素的电负性由大到小的顺序为________。
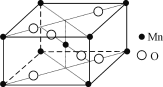
(4) 硝酸锰受热可分解生成NO2和某种锰的氧化物。该氧化物晶胞结构如右图所示。写出硝酸锰受热分解的化学方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,则下列说法正确的是( )
A. 0.1 mol/L K2SO4溶液含有K+ 0.2NA
B. 标准状况下,11.2L水所含的电子数为5NA
C. 常温常压下,16g O2含电子数为10NA
D. 0.1 mol Mg原子变成Mg2+时失去的电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是

A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
A. 0.1 mol 的![]() 中,含有
中,含有![]() 个中子
个中子
B. pH=1的H3PO4溶液中,含有![]() 个
个![]()
C. 2.24L(标准状况)苯在O2中完全燃烧,得到![]() 个CO2分子
个CO2分子
D. 密闭容器中1 mol PCl3与1 mol Cl2反应制备 PCl5(g),增加![]() 个P-Cl键
个P-Cl键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com