
����һ��Ӧ�ù㷺�Ľ�������ҵ����Al2O3�ͱ���ʯ��Na3AlF6��������ڵ���Ƶã�
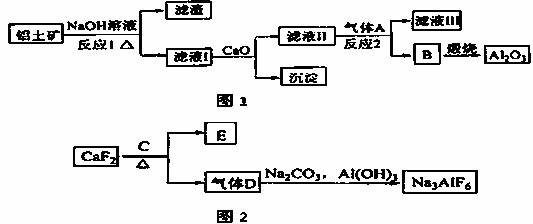
�����������Ҫ�ɷ���Al2O3��SiO2�ȣ���������������Al2O3��������ͼ1��ʾ��
����өʯ��CaF2���ʹ���Ϊԭ���Ʊ�����ʯ��������ͼ2��ʾ��
�ش��������⣺
��1��д����Ӧ1�Ļ�ѧ����ʽ_____________��_______ ___��
��2����Һ���м���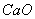 ���ɵij�����_______����ͨ�������A������Ӧ2�����ӷ���ʽΪ_____________��
���ɵij�����_______����ͨ�������A������Ӧ2�����ӷ���ʽΪ_____________��
��3��E�������������������Ӽ���������C��____��д����D�Ʊ�����ʯ�Ļ�ѧ����ʽ______________��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��B��C��D�����ֶ�����Ԫ�أ�E�ǹ���Ԫ�ء�A��B��Cͬ���ڣ�C��Dͬ���壬A��ԭ�ӽṹʾ��ͼΪ�� ��B��ͬ���ڵ�һ��������С��Ԫ�أ�C�������������δ�ɶԵ��ӣ�EԪ��+3��������Χ�����Ų�ʽΪ3d5���ش��������⣺
��B��ͬ���ڵ�һ��������С��Ԫ�أ�C�������������δ�ɶԵ��ӣ�EԪ��+3��������Χ�����Ų�ʽΪ3d5���ش��������⣺
��1��д��C��ԭ�ӽṹʾ��ͼ ��
��2��д��D���⻯��ĵ���ʽ ��
��3��D���ڵ������е縺������Ԫ�صĹ����ʾʽ ��
��4��EԪ�������ڱ��е�λ�� ��EԪ����Ԫ�����ڱ���_______����
��5��A��B��C���������ľ��������Ƿֱ���______ ���塢_____ _���塢_____ _���塣
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���й��� 0.2 mol/L �������Һ�������У���ȷ���� �� ��
A��1 L ����Һ�к������ 202 g
B��100 mL ����Һ�к������ 0.02 mol
C���� 1 L ����Һ��ȡ�� 500 mL ��ʣ����Һ��Ũ��Ϊ 0.1 mol/L
D��1 L ˮ���ܽ� 0.2 mol ����أ�������� 0.2 mol/L �������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������Ũ�ȶ�Ϊ0.1 mol/L��������Һ�У����루��ͨ�룩ij���ʺ�����Ӧ�Ⱥ�˳����ȷ����
A���ں�Fe3+��Cu2+��H+����Һ�м���п�ۣ�Cu2+��Fe3+��H+
B���ں�I����SO32����Br������Һ�в���ͨ��������I����Br����SO32��
C���ں�Fe3+��H+��NH4+����Һ����μ����ռ���Һ��Fe3+��NH4+��H+
D���ں�AlO2����SO32����OH������Һ����μ�������������Һ��OH����AlO2����SO32��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����£����и�����������Һ��һ���ܴ����������
A��1��0mol��L��KNO3��Һ��H+��Fe2+��Clһ��SO42һ
B.������Ӧ����������������Һ��Na+��K+��HCO3����NO3һ
C. pH=12����Һ��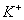 ��
��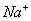 ��
�� ��Br-
��Br-
D. ��ˮ���������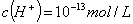 ����Һ��
����Һ��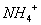 ��
��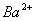 ��
��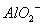 ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪HCN(aq)��NaOH(aq)��Ӧ����1 mol���εĦ�H����12.1 kJ/mol��ǿ�ᡢǿ���ϡ��Һ��Ӧ���к��Ȧ�H����57.3 kJ��mol��1����HCN��ˮ��Һ�е���Ħ�H����
A����69.4 kJ��mol��1 B����45.2 kJ��mol��1
C����69.4 kJ��mol��1 D����45.2 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���и����Ȼ�ѧ����ʽ�У���ѧ��Ӧ����Hǰ�ߴ��ں��ߵ���
��C(s)��O2(g)==CO2(g) ��H1 C(s)��1/2O2(g)==CO(g) ��H2
��S(s)��O2(g)==SO2(g) ��H3 S(g)��O2(g)==SO2(g) ��H4
��H2(g)��1/2O2(g)==H2O(l) ��H5 2H2(g)��O2(g)==2H2O(l) ��H6
��CaCO3(s)==CaO(s)��CO2(g) ��H7 CaO(s)��H2O(l)==Ca(OH)2(s) ��H8
A���� B���� C���ڢۢ� D���٢ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ѧ��Ƽ�����ᡢ�������н�ϣ������й�˵����ȷ����
A��������ˮ����ࡢ�����������������潡��
B��ά����C�����뺬���������IJ�Ѫ��ͬ��
C����ʳƷ���з���ʢ�й轺�����۵���С�����ɷ�ֹʳ���ܳ�����������
D��ζ���Ͼ�����ζ��ʳ�T����ʳ�����ʳ�ûᵼ��ѪҺƫ���ԣ�����ȱ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij���Ӻ���6�����ӡ�7�����ӣ��ʵ����ԣ������Ļ�ѧ���ſ�����( )A��13Al B��13Al�������� C��13C �������� D��13C
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com