
| A. | N2、H2和NH3的质量分数不再改变 | |
| B. | c(N2):c(H2):c(NH3)=1:3:2 | |
| C. | N2与H2的物质的量之和是NH3的物质的量2 | |
| D. | 单位时间里每增加1 mol N2,同时增加3 mol H2 |
分析 化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再发生变化,由此衍生的一些物理量不再变化,注意反应化学方程式中气体的化学计量数之和前后不等的特点,以此判断.
解答 解:A、N2、H2和NH3的质量分数不再改变,说明达到平衡状态,故A正确.
B、平衡时各物质的浓度取决于反应开始时的配料比以及反应转化的程度,不能用来判断是否达到平衡状态,故B错误;
C、平衡时各组分物质的量的多少决定于开始加入的多少,与平衡状态无关,所以不能用来判断该反应达到平衡状态,故C错误.
D、无论反应是否达到平衡状态,只要单位时间里每增加1molN2,同时增加3molH2,所以不能用来判断该反应达到平衡状态,故D错误.
故选A.
点评 本题考查化学平衡状态的判断,题目难度不大,注意方程式中气体的化学计量数关系,注意平衡时的浓度关系、物质的量关系不能作为判断是否平衡的依据.


科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,H2+Cl2=2HCl在光照和点燃条件的△H不同 | |
| B. | 铅蓄电池在放电过程中,负极质量减小,正极质量增加 | |
| C. | 天然气、沼气和水煤气分别属于化石能源、可再生能源和一级能源 | |
| D. | 元素原子的核外电子排布呈周期性变化是元素性质呈现周期性变化的根本原因 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
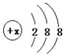 有几种元素的微粒电子层结构如图所示,其中:
有几种元素的微粒电子层结构如图所示,其中: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Na+2H2O=2NaOH+H2↑ | B. | 2Na2O2+2CO2=2Na2CO3+O2 | ||
| C. | Cl2+H2O?HC1+HC1O | D. | Na2CO3+BaC12=BaCO3↓+2NaC1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 混合气体的平均分子质量不变 | B. | 密闭容器中总压强不变 | ||
| C. | 混合气体的密度不变 | D. | 密闭容器中CO2的体积分数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| B12结构单元 | SF6分子 | S8分子 | HCN | |
| 结构模型示意图 |  |  |  |  |
| 备注 | 熔点1873K | / | 易溶于CS2 | / |
| A. | 单质B结构单元中含有30个B-B键,含20个正三角形 | |
| B. | SF6是由极性键构成的非极性分子 | |
| C. | 固态硫S8中S原子为sp2杂化 | |
| D. | HCN的结构式为H-C≡N |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HBrO4的酸性比HClO4的酸性强 | |
| B. | 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 | |
| C. | 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 | |
| D. | 硒化氢(H2Se)是无色、有毒且无硫化氢稳定的气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
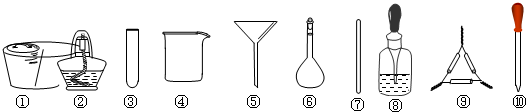
| A. | 将干海带剪碎后灼烧灰化,选用①、②和⑨ | |
| B. | 将海带灰加入蒸馏水搅拌煮沸,选用④、⑥和⑦ | |
| C. | 过滤得到的滤液,选用④、⑤和⑦ | |
| D. | 检验滤液中的I-,选用③、⑧和⑩ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com