
胃舒平主要成分是氢氧化铝,同时含有三硅酸镁(Mg2Si3O8.nH2O)等化合物。
1)三硅酸镁的氧化物形式为 ,某元素与镁元素不同周期但在相邻一族,且性质和镁元素十分相似,该元素原子核外电子排布式为 。
2)铝元素的原子核外共有 种不同运动状态的电子、 种不同能级的电子。
3)某元素与铝元素同周期且原子半径比镁原子半径大,该元素离子半径比铝离子半径 (填“大”或“小”),该元素与铝元素的最高价氧化物的水化物之间发生反应的离子方程式为:
4) Al2O3、MgO和SiO2都可以制耐火材料,其原因是 。
a.Al2O3、MgO和SiO2都不溶于水
b.Al2O3、MgO和SiO2都是白色固体
c.Al2O3、MgO和SiO2都是氧化物
d.Al2O3、MgO和SiO2都有很高的熔点
【答案】1)2MgO.3SiO.nH2O、1s22s1;2)13、5;3)大、Al(OH)3+OH-→AlO2-+2H2O;4)ad。
【解析】此题考查了硅化合物、元素周期表、原子的核外电子排布、原子的核外电子运动状态、元素周期律等知识。1)根据胃舒平中三硅酸镁的化学式和书写方法,其写作:2MgO.3SiO.nH2O;与镁元素在不同周期但相邻一族的元素,其符合对角线规则,故其是Li,其核外电子排布为:1s22s1;2)中铝元素原子的核外共有13个电子,其每一个电子的运动状态都不相同,故共有13种;有1s、2s、2p、3s、3p共5个能级;3)与铝元素同周期且原子半径大于镁的元素是钠,其离子半径大于铝的离子半径;两者氢氧化物反应的离子方程式为:Al(OH)3+OH-→AlO2-+2H2O;4)分析三种氧化物,可知三者都不溶于水且都具有很高的熔点。
技巧点拨:硅酸盐用氧化物的形式来表示组成的书写顺序是:活泼金属氧化物→较活泼金属氧化物→非金属氧化物→二氧化硅→水,并将氧化物的数目用阿拉伯数字在其前面表示。比如斜长石KAlSi3O8:K2O·Al2O3·6SiO2。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
下列关于元素性质的有关叙述中不正确的是
A. S Cl F H的原子半径依次减小
B. Na Mg Al Si的失电子能力依次增强
C. C N O F的气态氢化物的稳定性依次增强
D. Si P S Cl的最高价氧化物的水化物的酸性依次增强
查看答案和解析>>
科目:高中化学 来源: 题型:
过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,测定过氧化氢的含量。
请填写下列空白:
(1)移取10.00 mL密度为ρ g/mL的过氧化氢溶液至250 mL________(填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00 mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下:
2MnO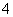 +5H2O2+6H+
+5H2O2+6H+ 2Mn2++8H2O+5O2↑
2Mn2++8H2O+5O2↑
(3)滴定时,将高锰酸钾标准溶液注入________(填“酸式”或“碱式”)滴定管中。滴定到达终点的现象是
_________________________________________。
(4)重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为________。
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果________(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等。请回答以下问题:
(1)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为___________;
(2)CuSO4粉末常用来检验一些有机物中的微量水分,其原因是_______;
(3)SO42-的立体构型是________,其中S原子的杂化轨道类型是_______;
(4)元素金(Au)处于周期表中的第六周期,与Cu同族,A u原子最外层电子排布式为______;一种铜合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为_______;该晶体中,原子之间的作用力是________;
u原子最外层电子排布式为______;一种铜合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为_______;该晶体中,原子之间的作用力是________;
(5)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构为CaF2的结构相似,该晶体储氢后的化学式应为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.形成离子键的阴阳离子间只存在静电吸引力
B.HF、HC L、HBr、HI的热稳定性和还原性从左到右依次减弱
L、HBr、HI的热稳定性和还原性从左到右依次减弱
C.第三周期非金属元素含氧酸的酸性从左到右依次增强
D.元素周期律是元素原子核外电子排布周期性变化的结果
查看答案和解析>>
科目:高中化学 来源: 题型:
元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构。下列推测不正确的是( )
A.同周期元素中X的金属性最强
B.原子半径X>Y,离子半径X+>Z2-
C.同族元素中Z的氢化物稳定性最高
D.同周期元素中Y的最高价含氧酸的酸性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
某元素只存在两种天然同位素,且在自然界它们的含量相近,其相对原子质量为152.0,原子核外的电子数为63。下列叙述中错误的是( )
A.它是副族元素
B.它是第六周期元素
C.它的原子核内有63个质子
D.它的一种同位素的核内有89个中子
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素E的氯化物ECln的熔点为-78℃,沸点为59℃;若0.2molECln与足量的AgNO3溶液完全反应后可以得到57.4g的AgCl沉淀。下列判断错误的是
A.E是一种非金属元素 B.在ECln中E与Cl之间形成共价键
C.E的一种氧化物为EO2 D.E位于元素周期表的IVA族
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com