
⑴ 质量分数为0.365密度为1.19g/cm3的浓盐酸,计算该盐酸的物质的量浓度;
⑵ 取上述盐酸50ml,稀释成100 mL溶液,加入15g CaCO3充分产生的气体体积在标准状况下是多少?
⑶ 将上述产生的气体全部通入500mL浓度为0.4mol/L的NaOH溶液中完全反应,所得溶液的组成是什么?求其物质的量浓度
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:


| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |






查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 催化剂 |
| △ |
| c2(SO3) |
| c(O2)?c2(SO2) |
| c2(SO3) |
| c(O2)?c2(SO2) |
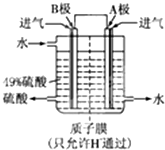
| O | - 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
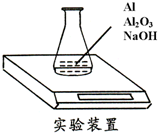 某种由Al与Al2O3粉末组成的混合物样品,利用如图装置测定混合物中Al的质量分数(已知样品质量为2.58g、锥形瓶和过量NaOH溶液的总质量为185.72g),每隔相同时间读得电子天平的数据如表:
某种由Al与Al2O3粉末组成的混合物样品,利用如图装置测定混合物中Al的质量分数(已知样品质量为2.58g、锥形瓶和过量NaOH溶液的总质量为185.72g),每隔相同时间读得电子天平的数据如表:| 读数次数 | 质量(g) | |
| 锥形瓶 + NaOH溶液 + 试样 |
第1次 | 188.30 |
| 第2次 | 188.28 | |
| 第3次 | 188.25 | |
| 第4次 | 188.24 | |
| 第5次 | 188.24 |
| 0.54g |
| 2.58g |
| 0.54g |
| 2.58g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
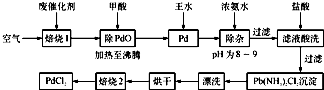
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com