
已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
A.原子半径A>B>C>D
B.原子序数a>b>c>d
C.离子半径C3->D->B+>A2+
D.单质的还原性A>B>D>C
科目:高中化学 来源:2014年化学高考总复习单元检测 第十、十一章有机、实验练习卷(解析版) 题型:选择题
下列实验现象预测正确的是( )


A.振荡后静置,上层溶液颜色保持不变
B.实验Ⅱ:酸性KMnO4溶液中出现气泡,颜色无变化
C.实验Ⅲ:微热稀硝酸片刻,溶液中有气泡产生,广口瓶内始终保持无色
D.实验Ⅳ:继续煮沸溶液至红褐色,停止加热,当光束通过体系时可产生丁达尔效应
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习单元检测 第八章水溶液中的离子平衡练习卷(解析版) 题型:选择题
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见图。下列说法正确的是( )
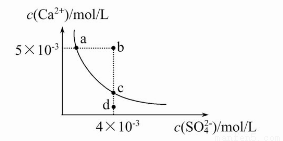
A.CaSO4在稀硫酸中的溶解性比在纯水中的溶解性强
B.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3 mol/L
C.d点溶液通过蒸发可以变到c点
D.a点对应的Ksp等于c点对应的Ksp
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习单元检测 第五章物质结构、元素周期律练习卷(解析版) 题型:填空题
短周期元素A、B、C、D、E的原子序数依次增大,其元素特征信息如表:

(1)D原子结构示意图为 _______ ,A在周期表中的位置为 。
(2)B和C形成的化合物的电子式为 。
(3)B和D简单离子的半径大小为 。
(4)元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中不可行的是 (填序号)。
a.比较两种单质的颜色
b.比较两种单质与H2化合的难易程度
c.依据两元素在周期表中的位置
d.比较对应阴离子的还原性
e.比较最高价氧化物对应水化物的酸性
(5)E元素能与另外四种元素中的一种元素形成共价化合物,分子中的原子个数比为1∶3,相对分子质量为120.5,则该物质的化学式为 。
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习单元检测 第五章物质结构、元素周期律练习卷(解析版) 题型:选择题
X、Y、Z是三种短周期的主族元素,在周期表中的位置如图所示,X原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )

A.原子半径:Y>Z>X
B.气态氢化物的热稳定性:X<Z
C.Y和Z的最高价氧化物对应水化物均为强酸
D.若Z的最高正价为+m,则X的最高正价也一定为+m
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习单元检测 第五章物质结构、元素周期律练习卷(解析版) 题型:选择题
某元素X原子的质量数为A,它的阴离子Xn-核外有x个电子,w克这种元素的原子核内中子物质的量为( )

查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习单元检测 第二章化学物质及其变化练习卷(解析版) 题型:选择题
下列离子方程式书写不正确的是( )
A.AlCl3溶液与烧碱溶液反应,当n(OH-)∶n(Al3+)=7∶2时, 2Al3++7OH-=Al(OH)3↓+ 
B.Cl2与FeBr2溶液反应,当n(Cl2)∶n(FeBr2)=1∶1时,2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
C.Ca(OH)2溶液与NaHCO3溶液反应,当
n[Ca(OH)2]∶n(NaHCO3)=1∶2时,
D.Fe与稀硝酸反应,当n(Fe)∶n(HNO3)=1∶2时,
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习单元检测 第九章电化学基础练习卷(解析版) 题型:填空题
某课外活动小组用如图装置进行实验,试回答下列问题。

(1)若开始时开关K与a连接,则B极的电极反应式为 。
(2)若开始时开关K与b连接,则B极的电极反应式为 ,
总反应的离子方程式为 。
有关上述实验,下列说法正确的是(填序号) 。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
(3)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。

①该电解槽的阳极反应式为 。
此时通过阴离子交换膜的离子数 (填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
②若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2014年化学高考复习演练4-5海水资源利用环境保护绿色化学练习卷(解析版) 题型:填空题
我国濒临海域的省份,能够充分利用海水制得多种化工产品。如图是以海水、贝壳(主要成分CaCO3)等为原料制取几种化工产品的工艺流程图,其中E是一种化肥,N是一种常见的金属单质。
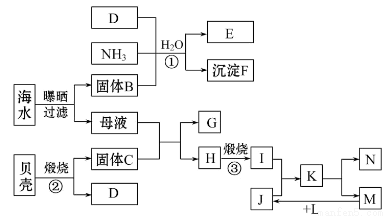
结合上述工艺流程回答下列问题:
(1)物质G和L的化学式分别为___________________和___________________。
(2)上述工艺流程中可以循环使用的物质的化学式为______________________。
(3)反应①的化学方程式为____________;在反应①中必须先通入NH3,而后通入D,其原因是_______________________________________________________。
(4)工业上利用F可制得另一种化工产品,该反应的化学方程式为____________。
(5)由K溶液经如何处理才能制得N?_________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com