
【题目】下列措施能减小室内空气污染的是
A. 大量使用人造板材料家具 B. 涂刷墙壁用水性溶剂洗涤
C. 烹饪燃料用固体煤球代替天然气 D. 室内装修可用含氡胡花岗账等大理石
 教学练新同步练习系列答案
教学练新同步练习系列答案科目:高中化学 来源: 题型:
【题目】近几年科学家发明的一种新型可控电池——锂水电池,工作原理如图所示。下列有关说法不正确的是( )

A. 石墨极发生的反应是2H2O+2e— === H2↑+2OH—
B. 有机电解质和水溶液不可以互换区域
C. 该装置不仅可提供电能,还可得到清洁的氢气
D. 标准状况下产生22.4 L的氢气时,正极消耗锂的质量为14 g
【答案】D
【解析】A、根据图示信息可知,石墨电极上产生H2,则石墨电极为正极,电极反应为:2H2O+2e=H2↑+2OH,故A正确;B、Li和有机电解质不反应,而Li和水反应,若Li和水接触,会有部分化学能直接转化为热能,所以有机电解质和水溶液不可以换区域,故B正确;C、该原电池是将化学能转化为电能的装置,装置不仅可提供电能,并且反应产物是氢气,能提供氢能源,故C正确;D、金属锂是负极,故D错误。故选D。
【题型】单选题
【结束】
26
【题目】一种新型的“锂-呼吸CO2电池”,结构如图所示,下列说法不正确的是

A. 该装置是化学能转变为电能
B. 利用该技术可减少温室气体CO2的排放
C. 正极的电极反应为:2CO2 + 2e- = C2O42-
D. 每生成10.2g Li2C2O4,有0.2mol Li+从正极迁移至负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的两种方法:
方法Ⅰ | 用炭粉在高温条件下还原CuO |
方法Ⅱ | 电解法的反应为2Cu+H2O |
(1)已知:2Cu(s) + 1/2 O2(g) = Cu2O(s) △H = -169KJ/mol
C(s) +1/2 O2(g) = CO(g) △H= -110.5kJ/mol
Cu(s) + 1/2 O2(g) = CuO(s) △H = -157kJ/mol
则方法Ⅰ反应的热化学方程式为______________________ 。
(2)方法Ⅱ采用肼(N2H4)燃料电池为电源,用离子交换膜控制电解液中c(OH-)制备纳米Cu2O,其装置如图甲、乙。


图甲 图乙
①上述装置中D电极应连接肼燃料电池的_______极(填“A”或“B”),该电解池中离子交换膜为______离子交换膜(填“阴”或“阳”)。
②该电解池的阳极反应式为_______________________________,肼燃料电池中A极发生的电极反应为___________________________________。
③当反应生成14.4 g Cu2O时,至少需要肼______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下图的虚线框中每一列、每一行相当于课本附录的元素周期表的每一族和每一周期,并已标出氢元素的位置,但它的列数和行数都多于元素周期表。请在虚线框中用实线画出周期表第一至第五周期的轮廓,并画出金属与非金属的分界线________。

(2)部分短周期主族元素的原子半径及主要化合价
元素 | 甲 | 乙 | 丙 | 丁 | 戊 | 己 | 庚 | 辛 |
原子半径(nm) | 0.077 | 0.143 | 0.111 | 0.104 | 0.066 | 0.186 | 0.037 | 0.099 |
主要化合价 | +4,-4 | +3 | +2 | +6,-2 | -2 | +1 | +1 | +7,-1 |
①乙元素的原子结构示意图____________,丙在元素周期表中的位置___________,戊、庚、辛以原子个数比1∶1∶1形成的化合物的结构式______________。
②甲的单质与丁的最高价氧化物的水化物反应的化学方程式是___________,辛的单质与己的最高价氧化物的水化物反应的离子方程式是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水四氯化锡是无色易流动的液体。熔点-33℃,沸点114.1℃。遇潮湿空气,水解而生成锡酸和氯化氢。下图是实验室制备无水四氯化锡并对产品蒸馏,制得纯净无水氧化锡的实验设计(加热及夹持装置已略去)。
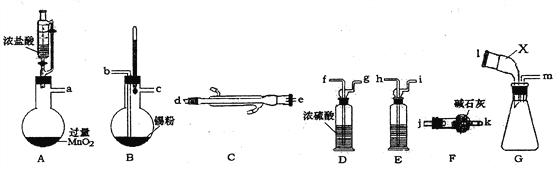
(1)装置A中反生反应的离子方程式_______________________。
(2)上述实验仪器口连接顺序为__________________________________。
(3)装置E中盛装试剂的名称为_________;上述实验正确的操作顺序为_____________。
①点燃装置A处酒精灯;②点燃装置B处酒精灯;③打开恒压漏斗活塞。
(4)装置G中仪器X的名称为___________。装置F的作用为_________________。
(5)将四氯化锡慢慢加水生成SnO2胶体和六氯合锡酸[H2[SnC16]],该反应的化学反应方程式为______________________。
(6)设计实验测定盐酸与MnO2反应的最低浓度,进行了如下操作:
I将装置A中液体加热至不再产生黄绿色气体为止,冷却过滤。
Ⅱ取上述滤液10mL稀释到400mL
III取稀释后溶液25.00mL加入指示剂进行滴定,滴定终点消耗0.2mol ·L-1的NaOH溶液19.25mL。
①上述条件下Mn2+开始沉淀的pH为5.2,则滴定时最好选用的指示剂为_____________。
②通过上述数据计算,盐酸与MnO2反应的最低浓度为__________(结果保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以含钴废催化剂(主要成分为Co、Fe、SiO2)为原料,制取氧化钴的流程如下:
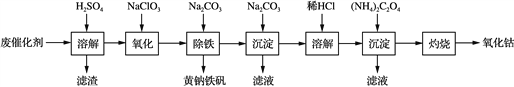
(1) 溶解:溶解后过滤,将滤渣洗涤2~3次,再将洗液与滤液合并的目的是________________________________________________________________________。
(2) 氧化:加热搅拌条件下加入NaClO3,将Fe2+氧化成Fe3+,其离子方程式是____________________________。
已知:铁氰化钾化学式为K3[Fe(CN)6];亚铁氰化钾化学式为K4[Fe(CN)6]·3H2O。
3Fe2++2[Fe(CN)6]3-===Fe3[Fe(CN)6]2↓(蓝色沉淀)
4Fe3++3[Fe(CN)6]4-===Fe4[Fe(CN)6]3↓(蓝色沉淀)
确定Fe2+是否氧化完全的方法是__________________________________。(可供选择的试剂:铁氰化钾溶液、亚铁氰化钾溶液、铁粉、KSCN溶液)
(3) 除铁:加入适量的Na2CO3调节酸度,生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,写出该反应的化学方程式:_____________________________________________________。
(4) 沉淀:生成沉淀碱式碳酸钴[(CoCO3)2·3Co(OH)2],沉淀需洗涤,洗涤的操作是________________________________________________________________________。
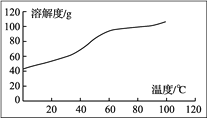
(5) 溶解:CoCl2的溶解度曲线如图所示。向碱式碳酸钴中加入足量稀盐酸,边加热边搅拌至完全溶解后,需趁热过滤,其原因是__________________________________________。
(6) 灼烧:准确称取CoC2O4 1.470 g,在空气中充分灼烧得0.830 g氧化钴,写出氧化钴的化学式:________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com