
�������������Ű�ҹ��ֵ���������SO2����ɿ�������Ⱦ����Ҫԭ�������Ƽ�ѭ�����ɳ�ȥSO2��
��1���Ƽ�ѭ�����У�����ҺΪNa2SO3��Һ���÷�Ӧ�����ӷ���ʽ��________��
��2����֪H2SO3�ĵ��볣��ΪK1��1.54��10��2��K2��1.024��10��7��H2CO3�ĵ��볣��ΪK1��4.30��10��7��K2��5.60��10��11�������������Դ����������______������ţ���
A.CO32�� HSO3�� B. HCO3�� HSO3�� C. SO32�� HCO3�� D. H2SO3 HCO3��
��3������Һ����SO2�Ĺ����У�pH��n(SO32��):n(HSO3��)�仯��ϵ���±���
|
n(SO32��):n(HSO3��) |
91:9 |
1:1 |
1:91 |
|
pH |
8.2 |
7.2 |
6.2 |
�ٸ����ϱ��ж�NaHSO3��Һ��_______�ԣ��Խ���ԭ��__________________________��
����NaHSO3��Һ������Ũ�ȹ�ϵ����ȷ����_______������ţ���
A��c(Na+)��2c(SO32-)+c(HSO3-)
B��c(Na+)��c(HSO3-)��c(H+)��c(SO32-)��c(OH-)
C��c(H2SO3)+ c(H+)��c(SO32-)+c(OH-)
D��c(Na+)+ c(H+)��2c(SO32-)+ c(HSO3-)+ c(OH-)
��4��������Һ��pH����ԼΪ6ʱ�����������۴�����ֱ���õ�pH��8������Һ��ѭ�����ã����ʾ��ͼ���£�
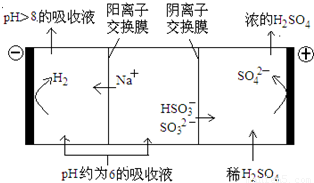
��д�������Ϸ����ĵ缫��Ӧʽ____________��
�ڵ��缫����1mol����ת��ʱ�������������Ϊ__________��
��1��SO32����SO2��H2O��2HSO3����1�֣�
��2��BC��2�֣�ȫ�Ե�2�֣��д����÷֣�ѡ��ȫ��1�֣�
��3�����ᣨ1�֣�����������������Һ��HSO3�����ڵ���ƽ�⣺HSO3�� SO32����H����ˮ��ƽ��HSO3����H2O
SO32����H����ˮ��ƽ��HSO3����H2O H2SO3��OH����HSO3���ĵ���̶�ǿ��ˮ��̶ȣ�����Һ�����ԣ�2�֣� ��A��1�֣�
H2SO3��OH����HSO3���ĵ���̶�ǿ��ˮ��̶ȣ�����Һ�����ԣ�2�֣� ��A��1�֣�
��4����HSO3����H2O��2e����SO42����3H����2�֣� ��1g��1�֣�
��������
�����������1���������Ƕ�Ԫ���ᣬ������������SO2ת��Ϊ��ʽ�Σ������Ƽ�ѭ�����У�����ҺΪNa2SO3��Һʱ��Ӧ�����ӷ���ʽΪSO32����SO2��H2O��2HSO3����
��2������ĵ��볣��Խ������Խǿ�������H2SO3�ĵ��볣��ΪK1��1.54��10��2��K2��1.024��10��7��H2CO3�ĵ��볣��ΪK1��4.30��10��7��K2��5.60��10��11��֪������ǿ��˳����H2SO3��H2CO3��HSO3����HCO3�������ݽ�ǿ�����Ʊ����������֪��CO32����HSO3����Ӧ����HCO3����SO32�������ܴ������棻H2SO3��HCO3����Ӧ����CO2��HSO3�������ܴ������档��HCO3����HSO3����SO32����HCO3�������Դ������棬��ѡBC��
��3��������SO32��ֻ��ˮ�⣬��Һ�Լ��ԣ����Ը���n(SO32��):n(HSO3��)��1:91ʱ��Һ�����Կ�֪��NaHSO3��Һ�����ԡ�����������������������Һ��HSO3�����ڵ���ƽ�⣺HSO3�� SO32����H����ˮ��ƽ��HSO3����H2O
SO32����H����ˮ��ƽ��HSO3����H2O H2SO3��OH����HSO3���ĵ���̶�ǿ��ˮ��̶ȣ�����Һ�����ԡ�
H2SO3��OH����HSO3���ĵ���̶�ǿ��ˮ��̶ȣ�����Һ�����ԡ�
�ڸ��������غ��֪��c(Na+)��c(SO32-)+c(HSO3-)+ c(H2SO3)��A����ȷ��B������HSO3���ĵ���̶�ǿ��ˮ��̶ȣ��Ҿ��Ǻ����ģ�������Һ��c(Na+)��c(HSO3-)��c(H+)��c(SO32-)��c(OH-)��B��ȷ��C�����ݵ���غ��֪c(Na+)+ c(H+)��2c(SO32-)+ c(HSO3-)+ c(OH-)�������غ��֪c(Na+)��c(SO32-)+c(HSO3-)+ c(H2SO3)����Һ��c(H2SO3)+ c(H+)��c(SO32-)+c(OH-)��C��ȷ��D�����ϵ���غ�c(Na+)+ c(H+)��2c(SO32-)+ c(HSO3-)+ c(OH-)��D��ȷ����ѡA��
��4���ٵ������������Դ������������ʧȥ���ӣ�����������Ӧ������װ�ÿ�֪�������������ɣ�������Һ��pH��6����Һ����Ҫ����HSO3-���ڣ�����������Ҫ��HSO3-�ŵ磬��������Ϸ����ĵ缫��ӦʽΪHSO3����H2O��2e����SO42����3H����
�ڵ����������õ����裬�����װ�ÿ��ж���������Һ�е������ӷŵ������������缫��ӦʽΪ2H����2e����H2�������缫����1mol����ת��ʱ�����õ�0.5mol�����������������������Ϊ0.5mol��2g/mol��1g��
���㣺�����������ε����ʡ�����ˮ�⡢������ʵĵ��롢���볣����Ӧ�á���Һ������Ũ�ȴ�С�Ƚ��Լ��绯ѧԭ����Ӧ�������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 �������������Ű�ҹ��ֵ���������SO2����ɿ�������Ⱦ����Ҫԭ�������Ƽ�ѭ�����ɳ�ȥSO2��
�������������Ű�ҹ��ֵ���������SO2����ɿ�������Ⱦ����Ҫԭ�������Ƽ�ѭ�����ɳ�ȥSO2��| O | 2- 3 |
| O | - 3 |
| O | - 3 |
| O | 2- 3 |
N��SO
|
91��9 | 1��1 | 1��91 | ||||
| pH | 8.2 | 7.2 | 6.2 |
2- 3 |
- 3 |
- 3 |
2- 3 |
2- 3 |
2- 3 |
- 3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ��ɽ��ʡ��У�����ڶ���������ѧ�Ծ��������棩 ���ͣ������
(8��)������������ֿ�ʼ��Ű�ҹ��ֵ���������SO2����ɿ�����Ⱦ����Ҫԭ�������Ƽ�ѭ�����ɳ�ȥSO2��
��1���Ƽ�ѭ�����У�����ҺΪNa2SO3��Һ�������շ�Ӧ�����ӷ���ʽ��
��2����֪H2SO3�ĵ��볣��Ϊ K1��1��54��10-2 , K2��1��02��10-7, H2CO3�ĵ��볣��Ϊ K1��4��30��10-7, K2�� 5��60��10-11,�����������Թ������_____________��
A��CO32- HSO3�� B��HCO3�� HSO3��
C��SO32- HCO3�� D��H2SO3 HCO3��
��3������Һ����SO2�Ĺ����У�pH��n(SO3²��):n(HSO3��)�仯��ϵ���±�:
|
n(SO3²��):n(HSO3��) |
91 ��9 |
1 ��1 |
1 ��91 |
|
pH |
8��2 |
7��2 |
6��2 |
���ϱ��ж�NaHSO3��Һ���������������ԣ���ԭ���ĽǶȽ���ԭ��������������������������
����NaHSO3��Һ������Ũ�ȹ�ϵ����ȷ����(ѡ����ĸ):������������������������
A����Na����= 2c��SO32-���� c��HSO3������
B����Na����> c��HSO3����> c��H����> c��SO32-��> c��OH����,
C����H2SO3��+ c��H����= c��SO32-��+ ��OH����,
D����Na����+ c��H����= 2 c��SO32-��+ c��HSO3����+ c��OH����
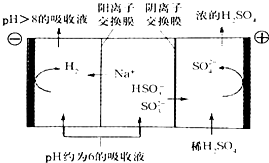
��4��������Һ��pH����ԼΪ6ʱ���������������� ������ʾ��ͼ����:

�� ����Һ���������е��ܷ�Ӧ����ʽ����������������������������������
�� ���缫����1mol����ת��ʱ��������Ϊ�������������ˣ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com