
下列有关的离子方程式正确的是
A.氯化铝溶液中加入过量氨水:Al3++4NH3·H2O= +4
+4
B.铜片接电源正极,碳棒接电源负极,电解硫酸溶液:
C.磷酸一氢钠溶液水【解析】 +H2O
+H2O
 +H3O+
+H3O+
D.实验室配制的亚铁盐溶液在空气中被氧化:4Fe2++O2+2H2O=4Fe3++4OH-
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源:2014高考名师推荐化学选做题练习5(解析版) 题型:填空题
A~F均为元素周期表中前四周期元素,其相关信息如下表:
元素 | 相 关 信 息 |
A | A的基态原子最外层电子排布式为2s22p3 |
B | B是地壳中含量最高的元素 |
C | C+与B的简单离子的电子层结构相同 |
D | D的一种核素的质量数为64,中子数为35 |
E 、F | E 、F既同周期又同族,且原子序数F比E多2 |
请回答下列问题:
(1)D的价电子的电子排布式是 ;F原子的原子结构示意图为 。
(2)A、B的第一电离能的大小顺序为 。
(3)AB3-中A原子的杂化轨道类型为_____;与A2B互为等电子体的分子的分子式为 (任写一个即可)。
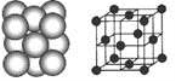
(4) D晶体的晶胞如图所示为面心立方最密堆积(在晶胞的顶点和面心均含有一个D原子)。则D的晶体中D原子的配位数为 。
(5)已知17gA的简单氢化物催化氧化生成气态水时放出QkJ的热量,请写出A的简单氢化物催化氧化的热化学反应方程式 。
(6)C2B2的电子式为____;它可与E的二氯化物溶液反应,若反应的C2B2与E的二氯化物的物质的量之比为1:2,则该反应的化学反应方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学离子的性质及检验(解析版) 题型:填空题
A、B、C、D四种可溶的化合物(所含离子各不相同),分别由阳离子Na+、Mg2+、Al3+、Ba2+和阴离子OH-、Cl-、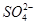 、
、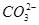 两两组合而成。为了确定这四种化合物的成分,某同学进行了如下实验操作:
两两组合而成。为了确定这四种化合物的成分,某同学进行了如下实验操作:
①将四种化合物各取适量配成溶液,分别装入四支试管。
②取A溶液分别滴入另外三种溶液中,记录实验现象如下:
B溶液白色沉淀沉淀不溶解
C溶液白色沉淀沉淀不溶解
D溶液白色沉淀沉淀部分溶解
③向B溶液中滴入D溶液,无明显实验现象。
请回答下列问题:
(1)写出它们的化学式:
A ;B ;C ;D ;
(2)上述②的第三次实验,再加入A,沉淀部分溶解的离子方程式 。
(3)③中若向C溶液中滴入D溶液,可能出现的实验现象是 。用离子方程式表示其原因: 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学离子的性质及检验(解析版) 题型:填空题
某无色溶液只可能含有以下几种离子:①Mg2+、②Al3+、③Fe2+、④H+、⑤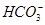 、⑥Cl-、⑦OH-。向其中缓慢地滴入NaOH溶液至过量,产生沉淀的质量与加入NaOH溶液的体积的关系如图所示,由此可确定原溶液中一定含有的离子是
、⑥Cl-、⑦OH-。向其中缓慢地滴入NaOH溶液至过量,产生沉淀的质量与加入NaOH溶液的体积的关系如图所示,由此可确定原溶液中一定含有的离子是
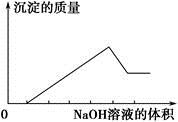
A.①②⑤ B.①③④ C.②⑥⑦ D.①②④⑥
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学离子方程式的书写及正误判断(解析版) 题型:选择题
下列离子方程式书写正确的是
A.氯化钙溶液中通入CO2气体:Ca2++CO2+H2O=CaCO3↓+2H+
B.碳酸钠溶液中逐滴加入等物质的量的盐酸: +2H+=CO2↑+H2O
+2H+=CO2↑+H2O
C.Ca(ClO)2溶液中通入过量的SO2气体:ClO-+SO2+H2O=HClO+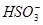
D.碳酸氢钙溶液中加入等物质的量的氢氧化钠溶液:Ca2++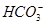 +OH-=CaCO3↓+H2O
+OH-=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学离子共存(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.0.1 mol·L-1 NaOH溶液:K+、Na+、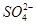 、
、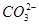
B.0.1 mol·L-1 Na2CO3溶液:K+、Ba2+、 、Cl-
、Cl-
C.0.1 mol·L-1 FeCl3溶液:K+、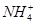 、I-、SCN-
、I-、SCN-
D.c(H+)/c(OH-)=1×1014的溶液:Ca2+、Na+、ClO-、
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学电解规律及电化学计算(解析版) 题型:填空题
某课外小组分别用下图所示装置对原电池和电解池原理进行实验探究。
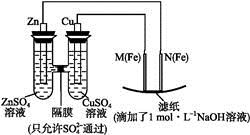
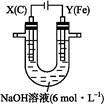
图1图2
请回答:
Ⅰ.用图1所示装置进行第一组实验。
(1)在保证电极反应不变的情况下,不能替代Cu作电极的是 (填序号)。
A.铝 B.石墨 C.银 D.铂
(2)N极发生反应的电极反应为 。
(3)实验过程中,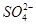 (填“从左向右”“从右向左”或“不”)移动;滤纸上能观察到的现象有 。
(填“从左向右”“从右向左”或“不”)移动;滤纸上能观察到的现象有 。
Ⅱ.用图2所示装置进行第二组实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(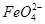 )在溶液中呈紫红色。
)在溶液中呈紫红色。
(4)电解过程中,X极区溶液的pH (填“增大”“减小”或“不变”)。
(5)电解过程中,Y极发生的电极反应为Fe-6e-+8OH-
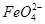 +4H2O和 。
+4H2O和 。
(6)若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况下的气体体积),则Y电极(铁电极)质量减少 g。
(7)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:
2K2FeO4+3Zn Fe2O3+ZnO+2K2ZnO2
Fe2O3+ZnO+2K2ZnO2
该电池正极发生的反应的电极反应为 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学选做题练习1(解析版) 题型:填空题
草酸(乙二酸)可作还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产。一种制备草酸(含2个结晶水)的工艺流程如下:
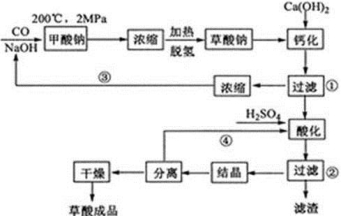
回答下列问题:
(1)CO和NaOH在一定条件下合成甲酸钠、甲酸钠加热脱氢的化学反应方程式分别为 。
(2)该制备工艺中有两次过滤操作,过滤操作①的滤液是 ,滤渣是 ;过滤操作②的滤液是 和 ,滤渣是 。
(3)工艺过程中③和④的目的是 。
(4)有人建议甲酸钠脱氢后直接用硫酸酸化制备草酸。该方案的缺点是产品不纯,其中含有的杂质主要是 。
(5)结晶水合草酸成品的纯度用高锰酸钾法测定。称量草酸成品0.250g溶于水中,用0.0500 mol/L的酸性KMnO4溶液滴定,至粉红色不消褪,消耗KMnO4溶液15.00mL,反应的离子方程式为 ;列式计算该成品的纯度 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com