
��ѧ��Ӧ�м������ʱ仯�����������仯���ͷŻ����������ǻ�ѧ��Ӧ�������仯����Ҫ��ʽ֮һ����֪C(ʯī)��H2(g)ȼ�յ��Ȼ�ѧ����ʽ�ֱ�Ϊ��
�� C(ʯī)+ O2(g)��CO(g)
O2(g)��CO(g) 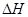 ="-111.0" KJ��mol-1
="-111.0" KJ��mol-1
�� H2(g)+  O2(g) ��H20(g)
O2(g) ��H20(g) 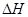 ="-242.0" kJ��mol-1
="-242.0" kJ��mol-1
�� C(ʯī)+O2(g)��CO2(g) 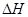 ="-394.0" kJ��mol-1
="-394.0" kJ��mol-1
�����������⣺
��1����ѧ��Ӧ���������仯�ı���ԭ���Ƿ�Ӧ�������� �Ķ��Ѻ��γɡ�����������Ӧ���� (����ȡ����ȡ�)��Ӧ��
��2�����Ȼ�ѧ����ʽ�У���Ҫ������Ӧ�P�������״̬��ԭ���� ���ڢ��У�02�Ļ�ѧ��������1/2���DZ�ʾ (����ĸ)��
a�����Ӹ��� b�����ʵ��� c����������
��3����Ӧ2H20(g)��2H2(g)+02(g)��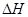 = KJ��mol-1��
= KJ��mol-1��
��4����C(���ʯ)+02(g)��C02(g)��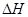 ="-395.0" kJ��mol-1�����ȶ��ԣ����ʯ (�����������������)ʯī��
="-395.0" kJ��mol-1�����ȶ��ԣ����ʯ (�����������������)ʯī��
��5����֪�γ�H20(g)�е�2 mol H-O���ܷų�926.0 kJ���������γ�1 mol 02(g)�еĹ��ۼ��ܷų�498.0 kJ�������������1 mol H2(g)�е�H-H����Ҫ������ KJ��
��6����ҵ��������һ����Ҫ;������CO(g)��H2O(g)��Ӧ����C02(g)��H2(g)����÷�Ӧ���Ȼ�ѧ����ʽ�� ��
��1����ѧ�� ����
��2����Ӧ���뷴Ӧ�P�������״̬�������йأ������𰸾��ɣ� b
��3��484.0 ��4���� ��5��435.0
��6��CO(g)��H2O(g)��CO2(g)��H2(g) ��H����41 kJ��mol��1
���������������2������״̬��ͬ�����е�������ͬ��״̬֮���ת�������������ı仯�������Ȼ�ѧ����ʽ�б���������ʵ�״̬����3���÷�Ӧ��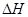 �Ƿ�Ӧ�ڵ�2�����෴�����ɷ���ʽ�жϣ����Ȼ�ѧ����ʽ�еļ�������ָ���ʵ�����û���۵ĺ��壻��4�����ʺ��е�����Խ�࣬�ȶ���Խ����ʯ����ʯī�ų��������ó����ʯ���������ߣ��ȶ��Բ
�Ƿ�Ӧ�ڵ�2�����෴�����ɷ���ʽ�жϣ����Ȼ�ѧ����ʽ�еļ�������ָ���ʵ�����û���۵ĺ��壻��4�����ʺ��е�����Խ�࣬�ȶ���Խ����ʯ����ʯī�ų��������ó����ʯ���������ߣ��ȶ��Բ
��5������1 mol H2(g)�е�H-H����Ҫ������=926.0-498.0��2- 242.0 ="435.0" KJ��
��6����Ӧ�ۣ��٣��ڵõ�CO(g)��H2O(g)��CO2(g)��H2(g) ��H����41 kJ��mol��1
���㣺���鷴Ӧ���й����⡣



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
2013���,�������������Ű�ҹ��ж�������������,����β����ȼúβ�����������������ԭ��֮һ��
��1������β����������Ҫԭ��Ϊ2NO��g��+2CO��g��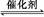 2CO2��g��+N2��g�������ܱ������з����÷�Ӧʱ,c��CO2�����¶ȣ�T���������ı������S����ʱ�䣨t���ı仯����,��ͼ��ʾ��
2CO2��g��+N2��g�������ܱ������з����÷�Ӧʱ,c��CO2�����¶ȣ�T���������ı������S����ʱ�䣨t���ı仯����,��ͼ��ʾ��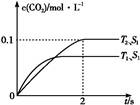
�ݴ��ж�:
�ٸ÷�Ӧ������������Ӧ������ȡ������ȡ�����
����T2�¶���,0��2 s�ڵ�ƽ����Ӧ����v��N2��=����������
�۵��������������һ��ʱ,���������������ѧ��Ӧ���ʡ��������ı����S1>S2,����ͼ�л���c��CO2����T1��S2�����´ﵽƽ������еı仯���ߡ�
�����÷�Ӧ�ھ��ȡ����ݵ��ܱ���ϵ�н���,����ʾ��ͼ��ȷ����˵����Ӧ�ڽ��е�t1ʱ�̴ﵽƽ��״̬����������������ţ��� 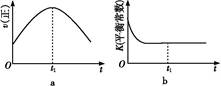

��2��ֱ���ŷ�úȼ�ղ������������������صĻ������⡣
��úȼ�ղ���������������������,��CH4����ԭNOx�������������������Ⱦ��
����:CH4��g��+2NO2��g�� N2��g��+CO2��g��+2H2O��g����H="-867" kJ/mol
N2��g��+CO2��g��+2H2O��g����H="-867" kJ/mol
2NO2��g�� N2O4��g������H="-56.9" kJ/mol
N2O4��g������H="-56.9" kJ/mol
д��CH4��g������ԭN2O4��g������N2��g����H2O��g�����Ȼ�ѧ����ʽ:�� ��
�ڽ�ȼú�����Ķ�����̼��������,�ɴﵽ��̼�ŷŵ�Ŀ�ġ���ͼ��ͨ���˹��������,��CO2��H2OΪԭ���Ʊ�HCOOH��O2��ԭ��ʾ��ͼ������b���淢���ĵ缫��ӦʽΪ������������������ 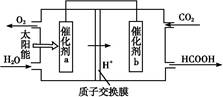
�۳�����,0.1 mol/L��HCOONa��ҺpHΪ10,��HCOO-ƽ�ⳣ��Kh=����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ����
(1)��ҵ��һ������������ַ�Ӧ�ϳɼ״���
��Ӧ��CO(g)��2H2(g) CH3OH(g)����H1
CH3OH(g)����H1
��Ӧ��CO2(g)��3H2(g) CH3OH(g)��H2O(g)����H2
CH3OH(g)��H2O(g)����H2
��������Ӧ���ϡ�ԭ�Ӿ��á�ԭ�����________(���)��
���±����������Ƿ�Ӧ���ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ��(K)��
| �¶� | 250 �� | 300 �� | 350 �� |
| K | 2.041 | 0.270 | 0.012 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��Ⱦ�뻷�������Ѿ���Ϊ�����ҹ������ŵ�һ�����⣬��Ⱦ��Ϊ������Ⱦ��ˮ��Ⱦ��������Ⱦ�ȡ�
��1��Ϊ�˼��ٿ�����SO2���ŷţ�����ȡ�Ĵ�ʩ�У�
�ٽ�úת��Ϊ�������ȼ�ϡ�
��֪��H2(g)��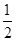 O2(g)=H2O(g) ��H1����241.8 kJ��mol��1
O2(g)=H2O(g) ��H1����241.8 kJ��mol��1
C(s)��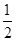 O2(g)=CO(g) ��H2����110.5 kJ��mol��1
O2(g)=CO(g) ��H2����110.5 kJ��mol��1
д����̿��ˮ������Ӧ���Ȼ�ѧ����ʽ�� ��
�÷�Ӧ��ƽ�ⳣ������ʽΪK�� ��
��ϴ�Ӻ�SO2���������������ʿ���ϴ�Ӽ����� ��ѡ����ţ���
a��Ca(OH)2 b��CaCl2 c��Na2CO3 d��NaHSO3
��2��Ϊ�˼��ٿ����е�CO2��Ŀǰ��̼�����ڽ������������ŷ��о�����Ҫ�����ã���̼������(NH4)2CO3����ӦΪ��(NH4)2CO3(aq)��H2O(l)��CO2(g)��2NH4HCO3(aq) ��H3Ϊ�о��¶ȶ�(NH4)2CO3����CO2Ч�ʵ�Ӱ�죬��ij�¶�T1�£���һ������(NH4)2CO3��Һ�����ܱ������У�������һ������CO2���壨�õ�����Ϊϡ�ͼ�������tʱ�̣����������CO2�����Ũ�ȡ�Ȼ��ֱ����¶�ΪT2��T3��T4��T5�£�����������ʼʵ���������䣬�ظ�����ʵ�飬������ͬʱ����CO2����Ũ�ȣ����ϵ��ͼ����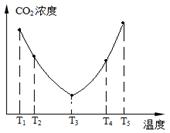
�٦�H3 0(�����������������)��
����T4��T5����¶����䣬������CO2����Ũ�ȱ仯���Ƶ�ԭ���ǣ� ��
��3�������������͵绯ѧ���ⷨ����������ˮ�������ε���Ⱦ��
�ٴ����������У���H2��NO3-��ԭΪN2��һ��ʱ�����Һ�ļ���������ǿ����Ӧ���ӷ���ʽΪ�� ��
�ڵ绯ѧ����NO3-��ԭ����ͼ����Դ����Ϊ�� ��ѡ���A����B������������ӦʽΪ�� ��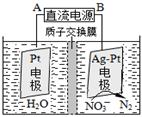
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�״�����Ϊȼ�ϵ�ص�ԭ�ϡ�ͨ�����з�Ӧ�����Ʊ��״���CO ( g ) + 2H2 ( g )  CH3OH ( g ) ��H��-90.8 kJ��mol��1 ��һ�ݻ��ɱ���ܱ������г���10 mol CO ��20 molH2��CO ��ƽ��ת�������¶ȣ�T����ѹǿ��P���ı仯��ͼ��ʾ�����ﵽƽ��״̬A ʱ�����������Ϊ20 L��
CH3OH ( g ) ��H��-90.8 kJ��mol��1 ��һ�ݻ��ɱ���ܱ������г���10 mol CO ��20 molH2��CO ��ƽ��ת�������¶ȣ�T����ѹǿ��P���ı仯��ͼ��ʾ�����ﵽƽ��״̬A ʱ�����������Ϊ20 L��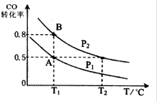
��1���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪ ��
��2���練Ӧ��ʼʱ�Գ���10mol CO ��20mol H2������ƽ��״̬Bʱ���������V��B��= L��
��3�����ڷ�ӦCO(g)+2H2(g) CH3OH(g)�ڻ�ѧƽ��״̬ʱ��������ȷ���� ������ĸ����
CH3OH(g)�ڻ�ѧƽ��״̬ʱ��������ȷ���� ������ĸ����
A��CO�ĺ������ֲ��� B��������CH3OHŨ����COŨ�����
C��2V����CH3OH��=V����H2��D�������л�������ƽ����Է����������ֲ���
��4��CO(g)+2H2(g) CH3OH(g)��������ͬ�����ʵ��� Ͷ�ϣ����CO�ڲ�ͬ�¶��µ�ƽ��ת������ѹǿ�Ĺ�ϵ��ͼ��ʾ������˵����ȷ���� ��
CH3OH(g)��������ͬ�����ʵ��� Ͷ�ϣ����CO�ڲ�ͬ�¶��µ�ƽ��ת������ѹǿ�Ĺ�ϵ��ͼ��ʾ������˵����ȷ���� ��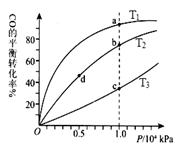
A���¶ȣ�T1 < T2 <T3
B������Ӧ���ʣ��ͣ�a��>�ͣ�c���� �ͣ�b��>�ͣ�d��
C��ƽ�ⳣ���� K(a) ="K(c)" �� K(b) >K(d)
D��ƽ��Ħ��������M(a)<M(c)�� M(b)>M(d)
��5����֪CO2��g��+H2��g�� CO��g��+H2O��g�� ��H=" +" 41.3 kJ��mol��1����д����
CO��g��+H2O��g�� ��H=" +" 41.3 kJ��mol��1�������
CO2��H2��ȡ�״����Ȼ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�������������ǵĽ���ϢϢ��أ�Ŀǰ�ҹ�ͨ�����6����Ⱦ�������Ũ���������������ָ����AQI����SO2��NO2��CO������3���е���Ⱦ�
��1������3������ֱ��������������������������� ���ѧʽ����
��2��������������ʹ��Ǧ�ҷ��������ᣬ����Ҫ��ӦΪ��
SO2��g����NO2��g�� SO3��g����NO��g��
SO3��g����NO��g��
������֪2SO2��g����O2��g�� 2SO3��g�� ��H��a kJ��mol��1
2SO3��g�� ��H��a kJ��mol��1
2NO��g����O2��g�� 2NO2��g�� ��H��b kJ��mol��1
2NO2��g�� ��H��b kJ��mol��1
��SO2��g����NO2��g�� SO3��g����NO��g�� ��H�� kJ��mol��1��
SO3��g����NO��g�� ��H�� kJ��mol��1��
��һ���¶��£���̶����Ϊ2 L���ܱ������г���SO2��NO2��1 mol��������Ӧ��SO2��g����NO2��g�� SO3��g����NO��g����������ʵ�в���˵���÷�Ӧ�ﵽƽ��״̬���� ��ѡ����ţ���
SO3��g����NO��g����������ʵ�в���˵���÷�Ӧ�ﵽƽ��״̬���� ��ѡ����ţ���
a����ϵѹǿ���ֲ��� b������������ɫ���ֲ���
c��NO�����ʵ������ֲ��� d��ÿ����1 mol SO3��ͬʱ����1 mol NO2
�۲�â��з�Ӧ5 minĩ����ƽ�⣬��ʱ������NO��NO2�������Ϊ3�U1�������ʱ����SO2�ķ�Ӧ���ʦԣ�SO2���� ���˷�Ӧ�ڸ��¶��µ�ƽ�ⳣ��K�� ��
��3���״�������Ϊ��Ҫ���л�ȼ�ϣ�ͨ������CO��H2�ϳɼ״����䷴Ӧ�Ļ�ѧ����ʽΪCO��g����2H2��g�� CH3OH��g��������һ�ݻ��ɱ���ܱ������У�����10 mol CO��20 mol H2�����ںϳɼ״���CO��ƽ��ת���ʣ��������¶ȣ�T����ѹǿ��P���Ĺ�ϵ��ͼ��ʾ��
CH3OH��g��������һ�ݻ��ɱ���ܱ������У�����10 mol CO��20 mol H2�����ںϳɼ״���CO��ƽ��ת���ʣ��������¶ȣ�T����ѹǿ��P���Ĺ�ϵ��ͼ��ʾ��
�������ϳɼ״��ķ�ӦΪ ��Ӧ������ȡ������ȡ�����
��A��B��C�����ƽ�ⳣ��KA��KB��KC�Ĵ�С��ϵΪ ��
�������ﵽƽ��״̬Aʱ���ɵļ״����ڹ��ɼ״�һ����ȼ�ϵ�أ��������ҺΪKOHŨ��Һ����õ�ع���ʱ�����ĵ缫��ӦʽΪ ��������ͨ�����·�ĵ������Ϊ mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�����ѣ�CH3OCH3������ɫ���壬����Ϊһ��������Դ���ɺϳ��������ΪH2��CO��������CO2��ֱ���Ʊ������ѣ�������Ҫ���̰��������ĸ���Ӧ����Ϊ���淴Ӧ����
��CO(g)+ 2H2(g) = CH3OH(g) ��H1=��90��1 kJ��mol-1
��CO2(g)+ 3H2(g) = CH3OH(g)+H2O(g) ��H2=��49��0 kJ��mol-1
ˮú���任��Ӧ��CO(g) + H2O (g)=CO2(g)+H2(g) ��H3=��41��1 kJ��mol-1
�����Ѻϳɷ�Ӧ��2CH3OH(g)=CH3OCH3(g)+H2O(g) ��H4=��24��5 kJ��mol-1
��1����H2��COֱ���Ʊ������ѣ���һ����Ϊˮ���������Ȼ�ѧ����ʽΪ ��
��2��һ���¶��£��ں����ܱ������н��з�Ӧ�٣�����������˵����Ӧ����ƽ��״̬���� ��
a.����������ƽ����Է����������ֲ���
b.�����������ܶȱ��ֲ���
c.CH3OH(g)Ũ�ȱ��ֲ���
d.CH3OH(g)���������ʵ���H2 (g)����������
��3��һ���¶��£���8mol CH3OH(g)����5L�ܱ������н��з�Ӧ�ܣ�һ��ʱ���ƽ��״̬����Ӧ�����й��ų�49kJ��������CH3OH(g)��ƽ��ת����Ϊ �����¶��£�ƽ�ⳣ��K= �����¶��£����������ٳ���2mol CH3OH(g)�����ٴδﵽ��ƽ��״̬���ж���ȷ���� ��
a.CH3OH(g)��ƽ��ת���ʼ�С
b.CH3OCH3 (g)�������������
c.H2O(g)Ũ��Ϊ0��5mol��L-1
d.�����е�ѹǿ��Ϊԭ����1��25��
��4�������ѡ�����ȼ�ϵ�ؾ��������죬Ч�ʸߵ��ŵ㣬�������ܶȸ��ڼ״�ȼ�ϵ�أ��������Ϊ���ԣ������ѡ�����ȼ�ϵ�صĸ�����ӦΪ ������2��8L(��״��)����ʱ���������������·�ĵ��� mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
������һ�����͵���ɫ��Դ������һ����Ҫ�Ļ���ԭ�ϡ�
��1������ȼ����ֵ�ߡ�ʵ���ã��ڳ��³�ѹ�£�1 g H2��ȫȼ������Һ̬ˮ���ų�142.9 kJ��������H2ȼ���ȵĻ�ѧ����ʽΪ ��
��2�������Ǻϳɰ�����Ҫԭ�ϣ��ϳɰ���Ӧ���Ȼ�����ʽ���£�N2(g)��3H2(g) 2NH3(g)����H����92.4 kJ/mol
2NH3(g)����H����92.4 kJ/mol
�ٵ��ϳɰ���Ӧ�ﵽƽ��ı�ijһ�������(���ı�N2��H2��NH3����)����Ӧ������ʱ��Ĺ�ϵ����ͼ��ʾ��ͼ��t1ʱ����ƽ���ƶ������������� ���б�ʾƽ��������NH3�ĺ�����ߵ�һ��ʱ���� 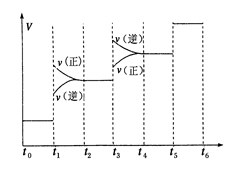
���¶�ΪT ��ʱ����2 a mol H2��a mol N2����0.5 L�ܱ������У���ַ�Ӧ����N2��ת����Ϊ50%����Ӧ��ƽ�ⳣ��Ϊ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�Ա���Ϊȼ����������ȼ�ϵ�أ���ص�����ͨ��O2��CO2������ͨ����飬�����������̼���Σ�����ܷ�Ӧ����ʽΪ��C3H8 +5O2 = 3CO2+ 4H2O��
��1����֪�� 2C3H8(g) + 7O2(g) =" 6CO(g)" + 8H2O(l) ?H1
C(s) + O2(g) = CO2 (g) ?H2
2C(s) + O2(g) = 2CO(g) ?H3
��C3H8(g) +5O2((g) = 3CO2(g) + 4H2O(l) ?H= ����?H1��?H2��?H3��ʾ��
��2��д���õ�������ĵ缫��Ӧʽ�� ����ع���ʱCO32������ ���øõ�ص��1000 mL 1mol/L��AgNO3��Һ���˵��صķ�Ӧ����ʽΪ �����������0��005 mol C3H8ʱ,�������Һ��pHΪ ����Һ����仯���Բ��ƣ���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com