
【题目】对于NaCl的下列叙述正确的是( )
A. 表示一个氯化钠分子 B. 在氯化钠中存在钠原子和氯原子
C. Na+与Cl-的结构示意图相同 D. Na+与Cl-之间存在离子键
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】F2和Xe在一定条件下可生成XeF2、XeF4和XeF6三种氟化氙,它们都是极强的氧化剂(其氧化性依次递增),都极易水解,其中:6XeF4+12H2O==2XeO3+4Xe↑ +24HF+3O2↑。下列推测正确的是( )
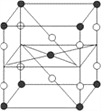
A. XeF2分子中各原子均达到八电子结构
B. 某种氟化氙的晶体结构单元如图,可推知其化学式为XeF6
C. XeF4按已知方式水解,每生成4molXe,转移16mol电子
D. XeF2加入水中,在水分子作用下将重新生成Xe和F2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A.图1表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJ·mol-1
B.图2表示压强对可逆反应2A(g)+2 B(g)![]() 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
C.图3表示等质量的钾、钠分别与足量水反应,则甲为钠
D.图4表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则相同条件下NaA溶液的pH大于同浓度的NaB溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】60年代美国化学家鲍林提出了一个经验规则:设含氧酸的化学式为HnROm,其中(m-n)为非羟基氧原子数,鲍林认为含氧酸的强弱与非羟基氧原子数(m-n)的关系见下表.
m-n | 0 | 1 | 2 | 3 |
含氧酸强度 | 弱酸 | 中强 | 强 | 很强 |
实例 | HClO | H3PO4 | HNO3 | HClO4 |
试回答下列问题:
(1)按此规则判断碳酸应属于_____酸。
(2)按此规则判断H3AsO4、H2CrO4、HMnO4酸性由弱到强的顺序为_______________。
(3)H3PO3和H3AsO3的形式一样,但酸性强弱相差很大.已知H3PO3为中强酸,H3AsO3为弱酸,试推断H3PO3和H3AsO3的分子结构__________________、________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是无机物 A~J在一定条件下的转化关系(部分产物及反应条件未列出)。其中C为红棕色气体;H和I是两种常见的金属单质;过量I与 D溶液反应生成A。

请填写下列空白:
(1)H元素在周期表中的位置是________;写出①的离子反应方程式:_________;检验E溶液中阳离子的最佳试剂为________。
(2)这类反应常用于冶炼高熔点的金属。用MnO2冶炼金属锰的反应中氧化剂与还原剂的物质的量之比为__________。
(3)SCR技术处理机动车尾气时,在催化条件下利用氨气与C反应,生成无污染的物质。发生反应的化学方程式为__________。
(4)F与NaClO、NaOH溶液反应,可制得一种“绿色”高效净水剂K2FeO4。每生成1molFeO42-时转移____________mol电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C的位置如图所示,已知B、C两元素所在族序数之和是A元素所在族序数的二倍,B、C两元素的原子序数之和是A元素的4倍,则A、B、C依次
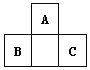
A. Be、Na、AlB. B、Mg、SiC. O、P、ClD. C、Al、P
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出表示含有8个质子、10个中子、10个电子的离子的符号__________。
(2)周期表中最活泼的非金属元素位于第_________纵行_________族。
(3)所含元素超过18种的周期是第_______、________周期。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍配合物在传感器、磁记录材料、储氢材料、电极催化剂和化学键研究等方面有着广泛的应用。以纯镍片为原料制备一种镍配合物[Ni(NH3)xCly]Clz·nH2O的主要流程如下:
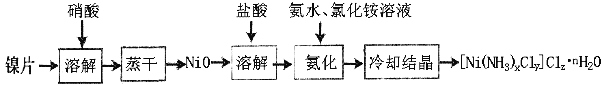
(1)工业上镍氢电池总反应式为:LaNi5H6 + NiOOH ![]() LaNi5 + Ni(OH)2,其中KOH作电解质溶液,负极电极反应式为:_______________________
LaNi5 + Ni(OH)2,其中KOH作电解质溶液,负极电极反应式为:_______________________
(2)常温下,镍投入60%的浓硝酸无明显现象,流程中需控制反应温度50-60oC,控温原因可能是_______,写出离子反应方程式:____________________________。
(3)冷却结晶后洗涤、过滤、干燥得到[Ni(NH3)xCly]Clz·nH2O,其中洗涤的正确操作是___________________________________________________________________。
(4)氨化过程中应控制溶液pH范围8~9,其原因是_____________________________。上述流程中,有关说法正确的是___________
A.氨化操作为在过量氨水和氯化铵缓冲溶液中,缓慢滴入酸化的NiCl2溶液,并不断搅拌
B.此缓冲溶液中微粒浓度大小顺序为:c(Cl—)> c(NH3·H2O) >c(NH4+) > c(OH—)> c(H+)
C.冷却结晶后的母液加适量氨水调节pH后可以循环利用
D.可以用热的浓硫酸和浓硝酸混合溶液代替浓硝酸溶解镍片
(5)为测定化合物[Ni(NH3)xCly]Clz·nH2O的组成,进行如下实验:
实验一:称取样品0.6460 g,加入过量的浓NaOH溶液,煮沸,冷却,蒸出的氨用40.00 mL 0.5000 mol·L-1的盐酸完全吸收,并用蒸馏水定容至100 mL,得溶液B。取B溶液20.00 mL,加入指示剂少量,用0.1000 mol·L-1NaOH滴定,消耗NaOH溶液20.00 mL。
实验二:另取该样品0.6460 g,溶于水,以0.1000 mol·L-1AgNO3溶液滴定至恰好反应完全,消耗AgNO3溶液20.00 mL。相应反应化学方程式为: [Ni(NH3)xCly]Clz+zAgNO3=[Ni (NH3)xCly] (NO3)z+zAgCl↓ 测得该镍配合物的化学式为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com