
【题目】下列图示的装置不属于原电池的是
A. 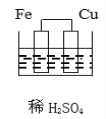 B.
B. 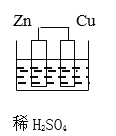
C. 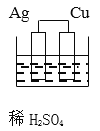 D.
D. 
【答案】C
【解析】
根据构成原电池条件,(1)有两种金属性不同的金属作电极,(2)有电解质溶液,(3)形成闭合回路;(4)能自发发生氧化还原还原反应;
A、铁和铜金属性不同,硫酸为电解质,构成闭合回路,且铁与稀硫酸发生氧化还原反应,符合原电池的构成条件,即该装置为原电池装置,故A不符合题意;
B、Zn、Cu金属性不同,硫酸为电解质,形成闭合回路,Zn与稀硫酸发生氧化还原反应,该装置为原电池装置,故B不符合题意;
C、Ag、Cu不与稀硫酸发生反应,不符合原电池构成条件,该装置不是原电池装置,故C符合题意;
D、Al、Cu金属性不同,硫酸为电解质,形成闭合回路,Al与稀硫酸发生氧化还原反应,符合原电池构成条件,故D不符合题意,答案选C。


科目:高中化学 来源: 题型:
【题目】下表为元素周期表中的一部分,表中列出了 11 种元素在周期表中的位置,按要求完成下列各小题。
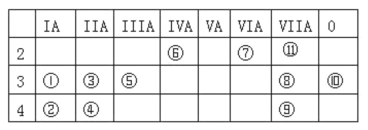
(1)化学性质最不活泼的元素是_____(填元素符号或化学式,下同),非金属性最强的单质与水反应的离子方程式是_______。
(2)①⑦⑧三种元素组成的化合物是84消毒液的主要成分,可以在碱性条件下处理含 CN-的废水,将CN-氧化成 CO32-和N2,写出反应的的离子方程式_____________________。
(3)用电子式表示③和⑧形成化合物的过程:________________。
(4)元素⑤的最高价氧化物与⑧的最高价氧化物对应的水化物反应的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有①熔融的BaCl2、②H2SO4溶于水、③NH4Cl溶于水、④Na2O2溶液、⑤干冰升华、⑥溴水被CCl4萃取六种物质,按下列要求回答:
(1)化学键没有破坏的是__________,仅破坏共价键的是________,仅破坏离子键的是________,离子键和共价键都破坏的是_____________。
(2)NH4Cl的电子式是________,CO2的结构和CS2相似,请你写出CS2的电子式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 向稀醋酸溶液中加入少量醋酸钠固体,醋酸的电离程度增大
B. 电镀时,通常把待镀金属制品作阴极,镀层金属作阳极
C. 常温下,2NO2(g)=2NO(g)+O2(g)不能自发进行,则该反应的△H>0
D. 工业通过反应“Na(l)+KCl(l) ![]() NaCl(l)+K(g)”冶炼钾,说明钠的金属性强于钾
NaCl(l)+K(g)”冶炼钾,说明钠的金属性强于钾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M、R均为主族元素,已知M的一个原子失去2个电子,R的一个原子得到1个电子后形成稀有气体元素的电子层结构。下列关于M与R形成的化合物的叙述正确的是( )
A. M与R可以形成MR2型离子化合物
B. 在MR2中M的离子半径比R的离子半径大
C. 形成的两种离子分别是M+和R2-
D. MR2的电子式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于NaCl的下列叙述正确的是( )
A. 表示一个氯化钠分子 B. 在氯化钠中存在钠原子和氯原子
C. Na+与Cl-的结构示意图相同 D. Na+与Cl-之间存在离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学平衡常数![]() ,电离平衡常数
,电离平衡常数![]() 或
或![]() ,水解平衡常数
,水解平衡常数![]() ,沉淀溶解平衡常数
,沉淀溶解平衡常数![]() ,水的离子积常数
,水的离子积常数![]() 的叙述中错误的是
的叙述中错误的是![]()
![]()
A. K值越大,正反应进行的程度越大,一般地说,![]() 时,该反应进行得就基本完全了
时,该反应进行得就基本完全了
B. 比较![]() 与离子积
与离子积![]() 的相对大小,可判断难溶电解质在给定条件下沉淀能否生成或溶解
的相对大小,可判断难溶电解质在给定条件下沉淀能否生成或溶解
C. K、![]() 或
或![]() 、
、![]() 、
、![]() 、
、![]() 都与温度有关,温度越高,常数值越大
都与温度有关,温度越高,常数值越大
D. 弱酸HA的![]() 与NaA的
与NaA的![]() 、水的离子积常数
、水的离子积常数![]() 三者间的关系可表示为:
三者间的关系可表示为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:![]() 已知
已知![]()
容器 | 甲 | 乙 | 丙 |
反应物的投入量 |
|
|
|
|
|
|
|
反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
体系的压强 |
|
|
|
反应物的转化率 |
|
|
|
下列说法正确的是![]()
![]()
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com