
【题目】下列关于化学平衡常数![]() ,电离平衡常数
,电离平衡常数![]() 或
或![]() ,水解平衡常数
,水解平衡常数![]() ,沉淀溶解平衡常数
,沉淀溶解平衡常数![]() ,水的离子积常数
,水的离子积常数![]() 的叙述中错误的是
的叙述中错误的是![]()
![]()
A. K值越大,正反应进行的程度越大,一般地说,![]() 时,该反应进行得就基本完全了
时,该反应进行得就基本完全了
B. 比较![]() 与离子积
与离子积![]() 的相对大小,可判断难溶电解质在给定条件下沉淀能否生成或溶解
的相对大小,可判断难溶电解质在给定条件下沉淀能否生成或溶解
C. K、![]() 或
或![]() 、
、![]() 、
、![]() 、
、![]() 都与温度有关,温度越高,常数值越大
都与温度有关,温度越高,常数值越大
D. 弱酸HA的![]() 与NaA的
与NaA的![]() 、水的离子积常数
、水的离子积常数![]() 三者间的关系可表示为:
三者间的关系可表示为:![]()
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】铝的单质及其化合物在生产、生活、科研等领城应用广泛。
Ⅰ、工业上用铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)制备铝的某种化合物的工艺流程如下:
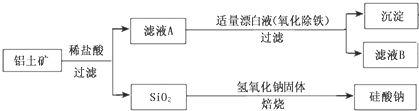
(1)加入盐酸时,氧化铝发生反应的离子方程式为______
(2)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。该过程中涉及某氧化还原反应如下,请完成:Fe2++___ClO-+ ═ Fe(OH)3↓+ Cl-+__________
Ⅱ、明矾在日常生活、生产中也占有一席之地。
(3)明矾是净水明星,用离子方程式表示其净水原理_____________________________。
(4)向0.02mol的明矾溶液中逐滴加入150mL0.2mol/LBa(OH)2溶液,生成沉淀的质量为 _____克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C的位置如图所示,已知B、C两元素所在族序数之和是A元素所在族序数的二倍,B、C两元素的原子序数之和是A元素的4倍,则A、B、C依次
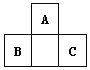
A. Be、Na、AlB. B、Mg、SiC. O、P、ClD. C、Al、P
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方法中,不能用于实验室里制取氨气的是
A. 在试管中将熟石灰和氯化铵混合后加热
B. 加热试管中的氯化铵固体
C. 将烧瓶中的浓氨水加热
D. 将分液漏斗中的浓氨水滴入装有生石灰的烧瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出表示含有8个质子、10个中子、10个电子的离子的符号__________。
(2)周期表中最活泼的非金属元素位于第_________纵行_________族。
(3)所含元素超过18种的周期是第_______、________周期。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质分类的说法正确的是( )
A.糖水、豆浆都属于溶液B.血液、墨水都属于胶体
C.分解反应都属于氧化还原反应D.氢气还原氧化铜属于离子反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含![]() 废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的
废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的![]() 和
和![]() 可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室
可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室![]() 下列叙述正确的是
下列叙述正确的是![]()
![]()
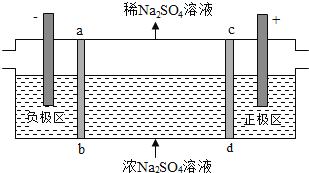
A. 通电后中间隔室的![]() 离子向正极迁移,正极区溶液pH增大
离子向正极迁移,正极区溶液pH增大
B. 该法在处理含![]() 废水时可以得到NaOH和
废水时可以得到NaOH和![]() 产品
产品
C. 负极反应为![]() ,负极区溶液pH降低
,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有![]() 的
的![]() 生成
生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工厂排放的SO2烟气对环境造成污染,某企业用下图流程综合处理,下列有关说法正确的是

A. 二氧化硫吸收塔中发生的反应为SO2+SO32-+H2O=2HSO3-
B. 氨气吸收塔中发生的反应为HSO3-+OH-=H2O+SO32-
C. 上述流程利用的是氧化还原反应原理
D. 上述流程可循环利用的物质有2种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com