
【题目】铝的单质及其化合物在生产、生活、科研等领城应用广泛。
Ⅰ、工业上用铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)制备铝的某种化合物的工艺流程如下:
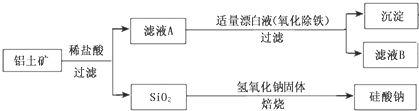
(1)加入盐酸时,氧化铝发生反应的离子方程式为______
(2)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。该过程中涉及某氧化还原反应如下,请完成:Fe2++___ClO-+ ═ Fe(OH)3↓+ Cl-+__________
Ⅱ、明矾在日常生活、生产中也占有一席之地。
(3)明矾是净水明星,用离子方程式表示其净水原理_____________________________。
(4)向0.02mol的明矾溶液中逐滴加入150mL0.2mol/LBa(OH)2溶液,生成沉淀的质量为 _____克。
【答案】Al2O3+6H+=2Al3++3H2O 2Fe2++1ClO-+5H2O=2Fe(OH)3↓+1C1-+4H+Al3++3H2O ![]() Al(OH)3+3H+8.55g
Al(OH)3+3H+8.55g
【解析】
Ⅰ.(1)氧化铝为两性氧化物,与酸反应生成盐和水,故答案为:Al2O3+6H+=2Al3++3H2O;
(2)滤液A中含有氯化铁和氯化亚铁、氯化铝,加入漂白液,目的是氧化除铁,所得滤液B显酸性,说明生成了氢离子,次氯酸根离子具有氧化性氧化亚铁离子生成铁离子,在溶液中形成氢氧化铁沉淀除去,次氯酸根离子被还原为氯离子,根据电子守恒和电荷守恒分析,所以反应的离子方程式为2Fe2++ClO-+5H2O=2Fe(OH)3↓+C1-+4H+,故答案为: 2Fe2++1ClO-+5H2O=2Fe(OH)3↓+1C1-+4H+ ;
Ⅱ.(3)明矾净水是明矾中的铝离子水解生成氢氧化铝胶体具有吸附作用,故答案为:Al3++3H2O ![]() Al(OH)3(胶体)+3H+;
Al(OH)3(胶体)+3H+;
(4)向0.02mol的明矾溶液中逐滴加入150mL0.2mol/LBa(OH)2溶液,铝离子恰好沉淀完全,则可生成0.02mol Al(OH) 3和0.03mol BaSO4,质量为:0.02mol×78g/mol+0.03mol×233g/mol=8.55g;故答案为:8.55;


科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示,已知W原子的最外层电子数比内层电子数少3个,下列说法正确的是( )
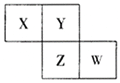
A. 氧化物对应水化物酸性W比Z强
B. Y单质与Z的氢化物水溶液反应,有沉淀生成
C. X单质在室温下为固体
D. 简单离子的半径:Z<W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表中的一部分,表中列出了 11 种元素在周期表中的位置,按要求完成下列各小题。
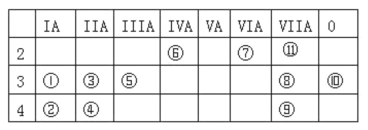
(1)化学性质最不活泼的元素是_____(填元素符号或化学式,下同),非金属性最强的单质与水反应的离子方程式是_______。
(2)①⑦⑧三种元素组成的化合物是84消毒液的主要成分,可以在碱性条件下处理含 CN-的废水,将CN-氧化成 CO32-和N2,写出反应的的离子方程式_____________________。
(3)用电子式表示③和⑧形成化合物的过程:________________。
(4)元素⑤的最高价氧化物与⑧的最高价氧化物对应的水化物反应的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能达到目的的实验方案是
A.用浓硫酸干燥氨气
B.用乙醇萃取溴水中的溴单质
C.用淀粉溶液鉴别溴水和碘水
D.用酚酞溶液鉴别氢氧化钠溶液和氢氧化钾溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质的应用正确的是( )
A.常温下干燥氯气与铁不反应,可以用钢瓶储存氯水
B.次氯酸钠具有强氧化性,可用于配制消毒液
C.“84”消毒液与“洁厕灵”混合使用,去污效果更好
D.液氯有酸性,氯水有漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有①熔融的BaCl2、②H2SO4溶于水、③NH4Cl溶于水、④Na2O2溶液、⑤干冰升华、⑥溴水被CCl4萃取六种物质,按下列要求回答:
(1)化学键没有破坏的是__________,仅破坏共价键的是________,仅破坏离子键的是________,离子键和共价键都破坏的是_____________。
(2)NH4Cl的电子式是________,CO2的结构和CS2相似,请你写出CS2的电子式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 向稀醋酸溶液中加入少量醋酸钠固体,醋酸的电离程度增大
B. 电镀时,通常把待镀金属制品作阴极,镀层金属作阳极
C. 常温下,2NO2(g)=2NO(g)+O2(g)不能自发进行,则该反应的△H>0
D. 工业通过反应“Na(l)+KCl(l) ![]() NaCl(l)+K(g)”冶炼钾,说明钠的金属性强于钾
NaCl(l)+K(g)”冶炼钾,说明钠的金属性强于钾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学平衡常数![]() ,电离平衡常数
,电离平衡常数![]() 或
或![]() ,水解平衡常数
,水解平衡常数![]() ,沉淀溶解平衡常数
,沉淀溶解平衡常数![]() ,水的离子积常数
,水的离子积常数![]() 的叙述中错误的是
的叙述中错误的是![]()
![]()
A. K值越大,正反应进行的程度越大,一般地说,![]() 时,该反应进行得就基本完全了
时,该反应进行得就基本完全了
B. 比较![]() 与离子积
与离子积![]() 的相对大小,可判断难溶电解质在给定条件下沉淀能否生成或溶解
的相对大小,可判断难溶电解质在给定条件下沉淀能否生成或溶解
C. K、![]() 或
或![]() 、
、![]() 、
、![]() 、
、![]() 都与温度有关,温度越高,常数值越大
都与温度有关,温度越高,常数值越大
D. 弱酸HA的![]() 与NaA的
与NaA的![]() 、水的离子积常数
、水的离子积常数![]() 三者间的关系可表示为:
三者间的关系可表示为:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com