
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示,已知W原子的最外层电子数比内层电子数少3个,下列说法正确的是( )
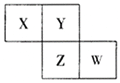
A. 氧化物对应水化物酸性W比Z强
B. Y单质与Z的氢化物水溶液反应,有沉淀生成
C. X单质在室温下为固体
D. 简单离子的半径:Z<W
【答案】B
【解析】
X、Y、Z、W均为短周期元素,W原子的最外层电子数比内层电子数少3个,则W的最外层电子数为7,为第三周期的Cl元素,结合元素在周期表中相对位置可以知道,Z为S,Y为O,X为N,以此来解答。
由上述分析可以知道,X为N,Y为O,Z为S,W为Cl,
A.非金属性Cl>S,最高价氧化物对应水化物酸性W比Z强,题中没有说明为最高价,则不能确定酸性强弱,故A错误;
B.氧气和硫化氢反应生成硫,溶液变浑浊,所以B选项是正确的;
C. X为N,X单质N2在室温下为气体,故C错误;
D.Z、W的简单离子具有相同的核外电子排布,核电荷数越大离子半径越小,故D错误。
所以B选项是正确的。


科目:高中化学 来源: 题型:
【题目】向10mL 1 mol·L-1的HCOOH溶液中不断滴加1 mol·L-1的NaOH溶液,并一直保持常温,所加碱的体积与-lg c水(H+)的关系如图所示。c水(H+)为溶液中水电离的c(H+)。下列说法不正确的是

A. 常温下,Ka(HCOOH)的数量级为10-4
B. a、b两点pH均为7
C. 从a点到b点,水的电离程度先增大后减小
D. 混合溶液的导电性逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分短周期元素原子半径的相对大小、最高正价或最低负价随原子序数的变化关系如图所示:

下列说法正确的是
A. 离子半径的大小顺序:e>f>g>h
B. 与x形成简单化合物的沸点:y>z>d
C. x、z、d三种元素形成的化合物可能含有离子键
D. e、f、g、h四种元素对应最高价氧化物的水化物相互之间均能发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬是一种具有战略意义的金属,它具有多种价态,单质铬熔点为1857 ℃。
(1)工业上以铬铁矿[主要成分是Fe(CrO2)2]为原料冶炼铬的流程如图所示:

①Fe(CrO2)2中各元素化合价均为整数,则铬为_______价。
②高温氧化时反应的化学方程式为_____________________。
③操作a由两种均发生了化学反应的过程构成的,其内容分别是__________、铝热反应。
(2)Cr(OH)3是两性氢氧化物,请写出其分别与NaOH、稀硫酸反应时生成的两种盐的化学式______________、___________________________。
(3)水中的铬元素对水质及环境均有严重的损害作用,必须进行无害化处理。
①处理含有Cr2O72-的污水方法通常为:用铁作电极电解污水,Cr2O72-被阳极区生成的离子还原成为Cr3+,生成的Cr3+与阴极区生成的OH结合生成Cr(OH)3沉淀除去。则阴极上的电极反应式为______________,若要处理含10 mol Cr2O72-的污水,则至少需要消耗的铁为_______g。
②转化为重要产品磁性铁铬氧体 (CrxFeyOz):先向含CrO42-的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气(氧化部分Fe2+)并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。写出CrO42-在酸性条件下被Fe2+还原为Cr3+ 的离子方程式:_____,若处理含1 mol CrO42-(不考虑其它含铬微粒)的污水时恰好消耗10 mol FeSO4,则当铁铬氧体中n(Fe2+)∶n(Fe3+)=3∶2时,铁铬氧体的化学式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,存在X→Y或Y→Z不能通过一步反应完成转化的一组是
选项 | X | Y | Z |
A | Al | NaAlO2(aq) | Al(OH)3 |
B | MgO | MgCl2(aq) | Mg |
C | H2O(g) | Fe3O4 | Fe |
D | NaOH(aq) | Na2CO3(aq) | NaHCO3(aq) |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是
A. 16 g O2和O3的混合气体中含有的分子数为0.5NA
B. 0.3 mol AgNO3受热完全分解(2AgNO3===2Ag+2NO2↑+O2↑),用排水法收集到气体的分子数为 0.25NA
C. 100 mL 12 mol·L-1浓盐酸与足量MnO2共热,生成的Cl2分子数为0.3NA
D. 2.3 g金属钠在装有氧气的集气瓶中完全燃烧,转移的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z和W代表原子序数依次增大的四种短周期主族元素.它们满足以下条件:①在元素周期表中,Z与Y、W均相邻;②X、Y、W分别位于不同周期;③Y、Z、W三种元素的原子最外层电子数之和为17。下列说法错误的是
A. X、Y、Z既能形成离子化合物.又能形成共价化合物
B. Y和Z元素的原子半径大小顺序为Y>Z
C. X与Y、Z之间形成的核外电子总数为10的微粒只有YX3和X2Z
D. Z、W元素的最简单氢化物的沸点和稳定性均为H2Z>H2W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝的单质及其化合物在生产、生活、科研等领城应用广泛。
Ⅰ、工业上用铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)制备铝的某种化合物的工艺流程如下:
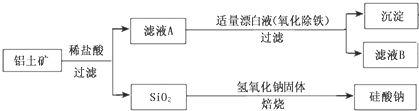
(1)加入盐酸时,氧化铝发生反应的离子方程式为______
(2)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。该过程中涉及某氧化还原反应如下,请完成:Fe2++___ClO-+ ═ Fe(OH)3↓+ Cl-+__________
Ⅱ、明矾在日常生活、生产中也占有一席之地。
(3)明矾是净水明星,用离子方程式表示其净水原理_____________________________。
(4)向0.02mol的明矾溶液中逐滴加入150mL0.2mol/LBa(OH)2溶液,生成沉淀的质量为 _____克。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com