
| A、鱼肝油 | B、水果 |
| C、动物肝脏 | D、豆制品 |
科目:高中化学 来源: 题型:
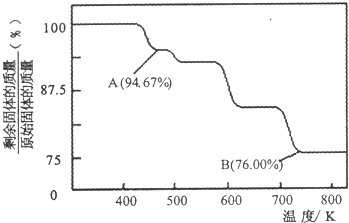
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该反应属于熵增放热反应,一定能自发进行 |
| B、5 min内H2的平均反应速率为0.1 mol/(L?min) |
| C、其它条件不变的情况下,加入催化剂可提高CO的转化率 |
| D、若该温度下,反应物的起始浓度c(CO)=4 mol/L,c(H2)=a mol/L,达到平衡后,c(CH3OH)=2 mol/L,则a=5.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蒸馏时,冷凝水应从冷凝管的下口通入、上口流出且将温度计水银球插入液体中 |
| B、分液时,分液漏斗下层液体从下口放出,上层液体也从下口放出 |
| C、萃取时,萃取剂的选取与密度无关 |
| D、蒸发时,当溶液中出现少量固体应停止加热,利用余热蒸干剩余溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 试剂 | 物质 | 试剂 |
| CuO(Al2O3) | FeCl3溶液(FeCl2) | ||
| NaHCO3溶液(Na2CO3) | Fe(Al) | ||
| C02(HCl) | Cu(Zn) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、O2和H2的混合气体 |
| B、0.05molH2 |
| C、大于0.05molH2 |
| D、小于0.05molH2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO和N2 |
| B、O3和SO2 |
| C、CO2和N2O |
| D、N2H4 和C2H4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com