���㣺��ѧƽ�ⳣ���ĺ���,��ѧ����ʽ���йؼ���,�ø�˹���ɽ����йط�Ӧ�ȵļ���,��ѧƽ���Ӱ������,���ԭ��
ר�⣺�����������������
��������1������Ӧ�ڸտ�ʼ����ʱ������HI����Ϸ�Ӧǰ�����������ʵ���������
��2����Ϸ���ʽ���㣻
��3��ƽ��ʱp�� NH
3����p��HI��=Kp
1��Kp
2=
����p��H
2��=p��I
2��=
��p��HI�����ɷ���ʽ��֪���ֽ��HI��δ�ֽ��HI֮�͵���NH
3�������Դ˽��
��A�����ݸ�˹���ɣ�����֪�Ȼ�ѧ����ʽ�����ʵ���ϵ�����мӼ�����Ŀ���Ȼ�ѧ����ʽ����Ӧ��Ҳ������Ӧ��ϵ����������Ӧ�ļӼ���
B�������백���Ƶ����N
2H
4���ǵ���ʣ�N
2H
4?H
2O��������ʣ�N
2H
4?H
2O���ڵ���ƽ������N
2H
5+��OH
-��
C��ԭ����ܷ�ӦΪN
2H
4+O
2=N
2+2H
2O��ԭ�������������ԭ��Ӧ�������������ŵ磬���������£������缫��ӦʽΪO
2+2H
2O+4e
-=4OH
-���ܷ�Ӧʽ��ȥ������Ӧʽ�ɵø����缫��Ӧʽ��
D��ԭ����ܷ�ӦΪN
2H
4+O
2=N
2+2H
2O����Ӧ����ˮ���淴Ӧ����KOH��ҺŨ�Ƚ��ͣ���ҺPHֵ��С��
��1�����ݻ��ϼ�������������Լ�ԭ���غ������
��2���ٸ��������غ㶨�ɣ��ڱ仯�����У�Cr������û�б䣬�����ԭ�Ӻ�ԭ�ӵĸ����ȼ��ɣ�
�������B�Ĺ���ijɷ֣�������ԭ���غ�д������ʽ��
��3����NaClΪ����ʣ�����������NaCl����ǿ��Һ�ĵ���������
���ȸ���KspFe��OH��
3��c��Fe
3+�����c��OH
-����Ȼ���ٸ���c��OH
-����KspCr��OH��
3���c��Cr
3+����
���
�⣺��1������Ӧ�ڸտ�ʼ����ʱ������HI����p��HI����С����Ӧǰ�����������ʵ������䣬����ѹǿ���䣬�ʴ�Ϊ����С������
��2��ƽ��ʱ����p�� NH
3��=d��p��H
2��=f����
NH
4I��s��?NH
3��g��+HI��g����
d d
2HI��g��?H
2��g��+I
2��g��
2f f f
��ƽ��ʱp��HI��=d-2f��
�ʴ�Ϊ��d-2f��
��3��ƽ��ʱp�� NH
3����p��HI��=Kp
1��Kp
2=
����p��H
2��=p��I
2��=
��p��HI����
�ɷ���ʽ��֪���ֽ��HI��δ�ֽ��HI֮�͵���NH
3������
��p��HI��+2
��p��HI��=p�� NH
3����
��p�� NH
3����p��HI��=Kp
1��
������ʽ�ɵ�p�� NH
3��=[Kp
1��2Kp
20.5+1��]
0.5��
�ʴ�Ϊ��[Kp
1��2Kp
20.5+1��]
0.5��
��A����֪����N
2��g��+2O
2��g��=2NO
2��g����H=+67.7kJ/mol
��2N
2H
4��g��+2NO
2��g��=3N
2��g��+4H
2O ��g����H=-1 135.7kJ/mol��
�ɸ�˹���ɣ���+�ڵ�2N
2H
4��g��+2O
2��g��=2N
2��g��+4H
2O��g����H=67.7kJ/mol-1135.7kJ/mol=-1068 kJ/mol��
��N
2H
4��g��+O
2��g��=N
2��g��+2H
2O��g����H=-534kJ/mol����A����
B��N
2H
4���ǵ���ʣ�N
2H
4?H
2O��������ʣ�N
2H
4?H
2O���ڵ���ƽ�⣬���뷽��ʽΪN
2H
4?H
2O?N
2H
5++OH
-����B����
C��ԭ����ܷ�ӦΪN
2H
4+O
2=N
2+2H
2O��ԭ�������������ԭ��Ӧ�������������ŵ磬���������£������缫��ӦʽΪO
2+2H
2O+4e
-=4OH
-���ܷ�Ӧʽ��ȥ������Ӧʽ�ɵø����缫��ӦʽΪN
2H
4-4e
-+4OH
-=N
2+4H
2O����C��ȷ��
D��ԭ����ܷ�ӦΪN
2H
4+O
2=N
2+2H
2O����Ӧ����ˮ���淴Ӧ����KOH��ҺŨ�Ƚ��ͣ����Լ�������ҺPHֵ��С����D����
�ʴ�Ϊ��C��
��1��CrO
3����ǿ�����ԣ������л����ƾ���ʱ���Ҵ������������ᣬ̼��ƽ�����ϼ۴�-2�����ߵ�0��1���Ҵ����ϼ۱仯4��CrO
3����ԭ����ɫ�������[Cr
2��SO
4��
3]�����Ļ��ϼ۴�+6�۽��͵�+3�ۣ�1��CrO
3���ϼ۱仯3�����ߵ���С��������12���ٸ���ԭ���غ��4CrO
3+3CH
3CH
2OH+12H
+�T4Cr
3++3CH
3COOH+9H
2O��
�ʴ�Ϊ��4CrO
3+3CH
3CH
2OH+12H
+�T4Cr
3++3CH
3COOH+9H
2O��
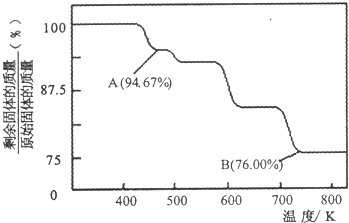
��2������CrO
3������Ϊ100g����CrO
3�и�Ԫ�ص�����Ϊ��100g��
=52g��A��ʱ���������Ϊ��100g��94.67%=94.67g��Co������û�б䣬������������Co������Ϊ52g����Ԫ�ص�����Ϊ42.67g�����ߵĸ�����Ϊ
��
=3��8������A��ʱʣ�����ijɷ���Cr
3O
8��
�ʴ�Ϊ��Cr
3O
8��
��B��ʱ���������Ϊ��100g��76%=76g��Cr������û�б䣬������������Cr������Ϊ52g����Ԫ�ص�����Ϊ16�����ߵĸ�����Ϊ
��
=2��3������B��ʱʣ�����ijɷ���Cr
2O
3�����Լ��ȵ� 750K ʱ�ɷ���Cr
2O
3����Ӧ����ʽΪ��4CrO
32Cr
2O
3+3O
2����
�ʴ�Ϊ��4CrO
32Cr
2O
3+3O
2����
��3������NaClΪ����ʣ�����������NaCl����ǿ��Һ�ĵ����������ʴ�Ϊ����ǿ��Һ�ĵ���������
����Һ��c��OH
-��=
=
mol/L=
mol/L������Һ��c��Cr
3+��=
=
=3.0��10��
6mol/L��
�ʴ�Ϊ��3.0��10��
6��
���������⿼���Ϊ�ۺϣ��漰��ѧƽ�ⳣ���ļ��㡢�Ȼ�ѧ����ʽ��ƽ���ƶ��������Լ����ܵ���ʵ�֪ʶ��Ϊ�߿��������ͣ�������ѧ���ķ��������ͼ��������Ŀ��飬ע�����ƽ�ⳣ���ļ��㣬Ϊ�״��㣬�Ѷ��еȣ�



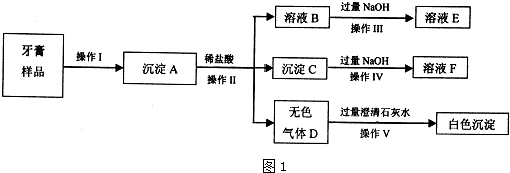
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
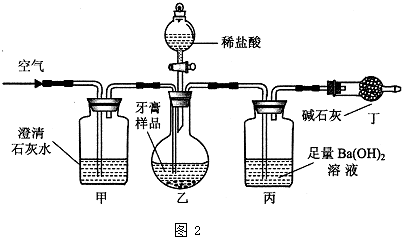
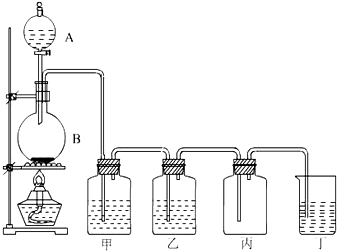 ʵ������������ʵ��װ��ͼ������ʾ��
ʵ������������ʵ��װ��ͼ������ʾ��