
��������ͼ���Ӧѡ������ȷ����
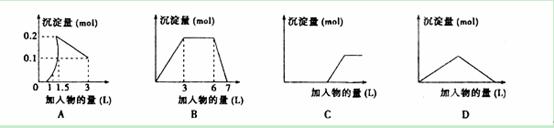
A����1LŨ�Ⱦ�Ϊ0��1mol��L-1��Ba��OH��2��NaAlO2���Һ����μ���0��1 mol��L-1ϡH 2SO4��Һ
2SO4��Һ
B������0��1 mol��L-1 AlCl3��0��3mol/L NH4Cl��1L���Һ����μ���0��1 mol��L-1NaOH��Һ
C�����ռ���Һ����μ���������Һ D����Ba��OH��2��Һ����ͨ�������̼����
 ������ÿ�ʱ�Ż���ҵϵ�д�
������ÿ�ʱ�Ż���ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ͼʾ���Ӧ�������������
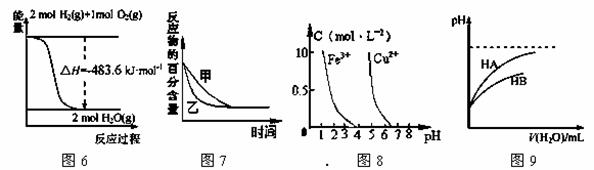 A��ͼ6��ʾH2��O2������Ӧ�����е������仯����H2��ȼ����Ϊ241.8 kJ��mol��1
A��ͼ6��ʾH2��O2������Ӧ�����е������仯����H2��ȼ����Ϊ241.8 kJ��mol��1
B��ͼ7��ʾѹǿ�Կ��淴Ӧ2A(g)+2 B(g) 3C(g)+D��s����Ӱ�죬�ҵ�ѹǿ�ȼ�ѹǿ��
3C(g)+D��s����Ӱ�죬�ҵ�ѹǿ�ȼ�ѹǿ��
C������ͼ8������ȥCuSO4��Һ�е�Fe3+��������Һ�м�������CuO������pH��4������
D��ͼ9��ʾ�����£�ϡ��HA��HB�������ϡ��Һʱ����ҺpH���ˮ���ı仯������ͬ������NaA��Һ��pH����ͬŨ�ȵ�NaB��Һ��pH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��10mol A��5mol B����10L������ڣ�ij�¶��·�����Ӧ��3A(g)��B(g) 2C(g)�����0.2s�ڣ�����A��ƽ������Ϊ0.06mol����L��s����1������0.2sʱ���������C�����ʵ����ǣ� ��
2C(g)�����0.2s�ڣ�����A��ƽ������Ϊ0.06mol����L��s����1������0.2sʱ���������C�����ʵ����ǣ� ��
A��0.12mol B��0.08mol C��0.04mol D��0.8mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
һ������������Һ�д����������������
�ٺ��д���Al3������Һ�У�Na����NH4+��SO42����Cl��
�ڼ���Al�ܷų�H2����Һ�У�Cl����HCO3����SO42����NH4+
�ۺ��д���Fe3������Һ�У�Na����Mg2����NO3����SCN��
���ں��д���AlO2������Һ�У�NH4+��Na����Cl����H��
����ˮ�������c(H��)��1��10��14mol��L��1����Һ�У�Ca2����K����Cl����HCO3��
A���٢� B���٢ۢ� C���� D���٢ܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�й�X��Y��Z��W���ֽ�����������ʵ�飺
| 1 | ��X��Y�õ������ӣ�����������Һ�У�Y����ʴ |
| 2 | ��Ƭ״��X��W�ֱ�Ͷ���Ũ�������ж������������W��X��Ӧ���� |
| 3 | �ö��Ե缫�������ʵ���Ũ�ȵ�Y��Z�������λ����Һ���������������� |
����������ʵ�������жϻ��Ʋ������ǣ� ��
A��Z����������������ǿ B��W�Ļ�ԭ��ǿ��Y�Ļ�ԭ��
C��Z����CuSO4��Һ��һ����Cu���� D����X��Z��ϡ����ɹ���ԭ��أ���X������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ȡһ�������ľ��ȹ�������Cu��Cu2O�� CuO������ֳ����ȷݣ�ȡ����һ����������������ԭ����÷�Ӧ�������������6.40g����һ���м���500mLϡ���ᣬ����ǡ����ȫ�ܽ⣬��ͬʱ�ռ�����״����NO����4.48L����������������ʵ���Ũ��Ϊ
A��2.8mol��L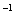 B��3.2mol��L
B��3.2mol��L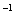 C��3.6mol��L
C��3.6mol��L D�����ж�
D�����ж�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�ҹ�ӵ����ȫ������Ȩ������ȼ�ϵ�س��ڰ��˻��ڼ�Ϊ�˶�Ա�ṩ����ij������ȼ�ϵ�صĵ��ҺΪKOH��Һ�������йص�ص���������ȷ���ǣ� ��
A��������ӦʽΪ��O2��2H2O��4e- == 4OH-
B���øõ�ص��CuCl2��Һ������2.24LCl2(���)ʱ����0.1mol����ת��
C����ȼ�ϵ�ص��ܷ�Ӧ����ʽΪ��2H2��O2==2H2O
D������һ��ʱ����Һ�е�KOH�����ʵ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�״����ӽ���Ĥȼ�ϵ���н��״�����ת��Ϊ���������ַ�Ӧԭ����
��CH3OH(g)+H2O(g)=CO2(g)+3H2(g)�� ��H= + 49��0 kJ��mol��1
��CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g)����H=��192��9 kJ��mol��1
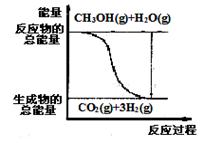 ����˵����ȷ����(����)
����˵����ȷ����(����)
A������CH3OH�ķ�Ӧ��Ϊ192��9 kJ��mol��1
B����Ӧ���е������仯����ͼ��ʾ
C��CH3OHת���H2�Ĺ���һ��Ҫ��������
D�����ݢ���֪��Ӧ�� CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)�� ��H>��192��9kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�ø�������(Na2FeO4)�ԺӺ�ˮ�����dz�������ˮ�������¼�����
��֪��ӦFe2O3��3Na2O2===2Na2FeO4��Na2O������˵����ȷ����( �� ��)
A��Na2O2�������������ǻ�ԭ��
B��Fe2O3�ڷ�Ӧ�еõ�����
C��3 mol Na2O2������Ӧ����12 mol e������ת��
D��Na2FeO4������ɱ�����������ǿ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com