
| A. | 甲烷与氯气混合光照反应后所得产物为4种 | |
| B. | 乙醇燃烧生成二氧化碳和水,说明乙醇具有氧化性 | |
| C. | 通入适量的H2可以除去乙烷中混有的乙烯杂质 | |
| D. | 制备乙酸乙酯可用饱和碳酸钠溶液收集 |
分析 A、甲烷和氯气在光照条件下发生反应,生成有机物有CH3Cl、CH2Cl2、CHCl3、CCl4,还有无机物HCl;
B、乙醇作燃料,是还原剂,具有还原性;
C、氢气为气体,引入新的杂质;
D、利用饱和碳酸钠溶液收集乙酸乙酯,可以降低乙酸乙酯在水中的溶解度,且除去乙酸与乙醇等杂质.
解答 解:A、甲烷和氯气在光照条件下发生反应,生成有机物有CH3Cl、CH2Cl2、CHCl3、CCl4,HCl,共有5种,故A错误;
B、乙醇燃烧生成二氧化碳和水,乙醇作燃料,是还原剂,具有还原性,故B错误;
C、乙烯可以与氢气发生加成反应生成乙烷,可是同时引入新的杂质气体氢气,故C错误;
D、利用饱和碳酸钠溶液收集乙酸乙酯,饱和碳酸钠可以降低乙酸乙酯在水中的溶解度,且除去乙酸与乙醇等杂质,故D正确;
故选D.
点评 本题主要考查的是常见有机化合物的性质,混合物的除杂、乙酸乙酯的制取与收集等,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 1 mol/L | B. | 0.5mol/L | C. | 0.25mol/L | D. | 0.2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
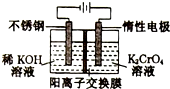
| A. | 电解过程中,K+由阴极室通过阳离子交换膜移阳极室 | |
| B. | 在阴极室,发生的电极反应为:2H++2e-═2H2↑ | |
| C. | 该电解过程实质是电解水 | |
| D. | 在阳极室,通电后溶液逐渐由黄色变为橙色,是因为H+浓度增大,使平衡2CrO42-(黄色)+2H+?Cr2O32-(橙色)+H2O向右移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ⅰ中溶液不分层,溶液由棕黄色变成浅绿色 | |
| B. | Ⅱ中溶液分层,下层呈紫红色 | |
| C. | Ⅲ中溶液分层,下层呈紫红色 | |
| D. | Ⅳ中溶液分层,下层呈紫红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 实验 内容 |  |  |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇是一种低碳能源,在全球能源危机和环境污染的背景下具有良好的发展前景.在催化剂作用下可用H2和CO合成甲醇,反应的化学方程式为2H2(g)+CO(g) $\stackrel{催化剂}{?}$CH3OH(g),三种物质的物质的量浓度随时间变化的关系如图1所示.试回答下列问题:
甲醇是一种低碳能源,在全球能源危机和环境污染的背景下具有良好的发展前景.在催化剂作用下可用H2和CO合成甲醇,反应的化学方程式为2H2(g)+CO(g) $\stackrel{催化剂}{?}$CH3OH(g),三种物质的物质的量浓度随时间变化的关系如图1所示.试回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com