
【题目】已知硫酸钠晶体(Na2SO4·10H2O)中钠离子数目3.01×1023,请计算填空:
(1)钠离子的物质的量是_____,硫酸钠晶体的物质的量是______。
(2)所含硫酸根离子的物质的量是______,硫酸根离子的数目是______。
(3)所含结晶水的物质的量是____,所含氧原子的物质的量是______。
【答案】0.5mol; 0.25mol; 0.25mol; 0.25NA; 2.5mol; 3.5mol。
【解析】
根据n=N/NA计算钠离子物质的量,再根据化学式(Na2SO4·10H2O)的组成进行计算。
(1)钠离子物质的量![]() ,
,
硫酸钠晶体的物质的量n(Na2SO4)=0.5÷2=0.25mol;
故答案为:0.5mol;0.25mol;
(2)硫酸根离子的物质的量n(SO42-)=1×0.25mol=0.25mol;硫酸根离子的数目N(SO42-)=0.25NA;
故答案为:0.25mol,0.25NA;
(3)结晶水的物质的量n(H2O)=10×0.25mol=2.5mol,所含氧原子的物质的量n(O)=14×0.25mol=3.5mol;
故答案为:2.5mol;3.5mol。


 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
【题目】请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化后气化的方法提纯,其除杂质过程为把杂质用热的重铬酸钾(K2Cr2O7)酸性溶液浸泡发生反应,溶液逐渐变成浅绿色(Cr3+),同时产生使澄清石灰水变浑浊的气体,写出反应的离子方程式:____________________________________________。
(2)焦炭可用于制取水煤气。测得24g碳与水蒸气完全反应生成水煤气时,吸收了263.2kJ热量。该反应的热化学方程式为_________________________________。
(3)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为CO(g)+2H2(g) ![]() CH3OH(g) △H1=-116kJ·mol-1。
CH3OH(g) △H1=-116kJ·mol-1。
①下列措施有利于提高反应物转化率的是___________(填序号)。
A.及时将CH3OH与反应混合物分离 B.降低反应温度
C.减小体系压强 D.使用高效催化剂
②乙醇电池具有很高的实用价值。如右图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。该电池的负极反应式为_________________________________。

③已知:CO(g)+![]() O2(g)=CO2(g) △H2=-283 kJ·mol-1
O2(g)=CO2(g) △H2=-283 kJ·mol-1
H2(g)+ ![]() O2(g)=H2O(g) △H3=? kJ·mol-1
O2(g)=H2O(g) △H3=? kJ·mol-1
1mol气态甲醇完全燃烧生成CO2和水蒸气时放出热量651kJ,则△H3=________________。
④在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律,如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。请回答下列问题:

(i)在上述三种温度中,曲线X对应的温度是______________________。
(ii)利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H2(g)![]() CH3OH(g)的平衡常数K=___________。
CH3OH(g)的平衡常数K=___________。
(4)CO2经常用氢氧化钠溶液来吸收,现有0.2moCO2,若用100mL3 mol/LNaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验基本操作不正确的是( )
A.容量瓶用蒸馏水洗涤后须烘干才能使用
B.可以用10 mL量筒量取8.0 mL稀硫酸
C.配制氯化铁溶液时,可将氯化铁溶解在较浓的盐酸中,然后再加水稀释
D.蒸馏操作时先通冷却水再加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为一“铁链”图案,图案上由左到右分别写了H2O、CO2、Na2O、NaCl、FeCl35种物质,图中相连的两种物质均可归属为一类,相交部分由左到右A、B、C、D为其相应的分类依据代号。请回答下列问题:

(1)请将分类依据代号填入相应的括号内:
(____)两种物质都是非金属氧化物
(____)两种物质都是钠的化合物
(____)两种物质中一种是酸性氧化物,一种是碱性氧化物
(____)两种物质都是盐
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入图中某种物质M的水溶液,继续煮沸可制得一种红褐色胶体。
①物质M的化学式为________。
②证明有红褐色胶体生成的最常用的实验操作是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:
(1)水质优劣直接影响人体健康.天然水在净化处理过程中加入的混凝剂可以是 (填两种物质的名称),其净水作用的原理是
(2)水的净化与软化的区别是
(3)硬度为1°的水是指每升水含10mg CaO或与之相当的物质(如7.1mg MgO).若某天然水中c(Ca2+)=1.2×10﹣3mol/L,c(Mg2+)=6×10﹣4mol/L,则此水的硬度为 .
(4)若(3)中的天然水还含有c(HCO3﹣)=8×10﹣4mol/L,现要软化10m3这种天然水,则需先加入Ca(OH)2 克,后加入Na2CO3 克.
(5)如图是电渗析法淡化海水的原理图,其中,电极A接直流电源的正极,电极B接直流电源的负极.

①隔膜A是 (填“阴”或“阳”)离子交换膜;
②某种海水样品,经分析含有大量的Na+、Cl﹣,以及少量的K+、SO42﹣.若用上述装置对该海水进行淡化,当淡化工作完成后,A、B、C三室中所得溶液(或液体)的pH分别为pHa、pHb、pHc,则其大小顺序为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年新春之际,出现了罕见的新型冠状病毒肺炎,威胁着人们的身体健康。以下消毒剂可以有效地灭活病毒,走进了百姓的生活中。下列叙述中,不正确的是
A.高锰酸钾(KMnO4)是电解质
B.H2O2分子中所有原子都达到了8电子结构
C.次氯酸钠(NaClO)是离子化合物
D.医用酒精是体积分数为75%的乙醇溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用生产钛白的副产品FeSO4与软锰矿(主要成分是MnO2)可制备高纯MnO2。
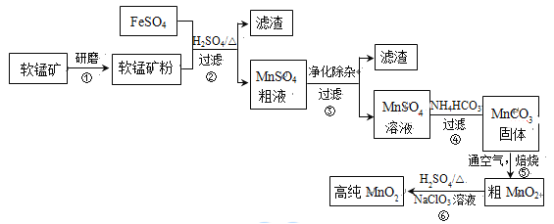
(1)步骤①中研磨的目的是_________。
(2)步骤②中主要发生的反应是FeSO4与MnO2转化为MnSO4与_________。
(3)步骤②中Mn2+浸出率受初始H2SO4浓度与温度的影响如下图所示。

软锰矿粉酸浸的适宜条件是__________。
(4)步骤②中,若硫酸初始浓度小于1.8mol/L,反应进行一段时间后,有红褐色固体析出,其原因是____________。
(5)已知MnSO4粗液中还含有Al3+、Fe3+和Ni2+离子,溶液中离子生成氢氧化物的pH如下表:
Al(OH)3 | Fe(OH)3 | Ni(OH)2 | Mn(OH)2 | |
开始沉淀时pH | 3.4 | 1.5 | 6.9 | 8.2 |
完全沉淀时pH | 4.7 | 2.8 | 8.9 | 10.2 |
注:金属离子的起始浓度为0.1mol/L
步骤③进行的操作是:调节pH=5.4,过滤,滤渣中含_____。
(6)已知:几种难溶物的溶解平衡常数K
化学式 | MnCO3 | NiCO3 | MnS | NiS |
K | 2.24×10-11 | 1.42×10-7 | 4.65×10-14 | 1.07×10-21 |
步骤③还需加入的除杂试剂是_______固体(填序号)。
a.Na2CO3 b.MnCO3 c.Na2S d.MnS
(7)步骤⑤中焙烧MnCO3制MnO2,发生反应的化学方程式是______。固体产物除MnO2外,还可能存在______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从元素化合价升降的角度分析,下列不属于氧化还原反应的是
A. H2+Cl2![]() 2HCl B. 2HClO
2HCl B. 2HClO![]() 2HCl+O2
2HCl+O2
C. 2NaI+Br2=2NaBr+I2 D. CaCl2+Na2CO3=CaCO3↓+2NaCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com