
【题目】具有相同电子层数的![]() 、
、![]() 、
、![]() 三种元素,已知它们最高价氧化物的水化物的酸性强弱顺序是
三种元素,已知它们最高价氧化物的水化物的酸性强弱顺序是![]() ,则下列判断正确的是( )
,则下列判断正确的是( )
A.原子半径:![]()
B.元素的非金属性:![]()
C.气体氢化物的稳定性:![]()
D.阴离子的还原性:![]()
【答案】B
【解析】
X、Y、Z三种元素的原子具有相同电子层数,应为同一周期元素,它们的最高价氧化物对应水化物是HXO4、H2YO4、H3ZO4,则X的最外层电子数为7,Y的最外层电子数为6,Z的最外层电子数为5,为非金属,原子序数X>Y>Z,根据同一周期元素的性质变化规律分析解答。
根据上述分析,Z、Y、X是同一周期,从左到右依次排列的三种元素,它们的最高价氧化物对应水化物是HXO4、H2YO4、H3ZO4。
A.同周期,从左到右,原子半径减小,则原子半径为X<Y<Z,故A错误;
B.它们最高价氧化物的水化物的酸性强弱顺序是HXO4>H2YO4>H3ZO4,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,所以非金属性:X>Y>Z,故B正确;
C.元素的非金属性越强,对应的氢化物的稳定性越强,非金属性:X>Y>Z,则气态氢化物稳定性:X>Y>Z,故C错误;
D.元素的非金属性越强,对应的阴离子的还原性越弱,非金属性:X>Y>Z,所以阴离子的还原性:X<Y<Z,故D错误;
故选B。


科目:高中化学 来源: 题型:
【题目】25℃时,醋酸的电离常数为1.8×10-5。向20mL2.0mol/LCH3COOH溶液中逐滴加入2.0mol/LNaOH溶液,溶液中水电离出的c(H+)在此滴定过程中变化曲线如图所示。下列说法正确的是( )
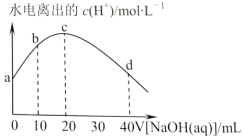
A.a点水电离出的c(H+)=6.0×10-3mol/L
B.b点c(CH3COOH)>c(Na+)>c(CH3COO-)
C.c点恰好完全反应,溶液中无CH3COOH
D.d点c(Na+)=2c(CH3COO-)+2c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16,Ksp(Ag2CrO4)=2.0×10-12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是( )
A. AgCl>AgI>Ag2CrO4 B. AgCl>Ag2CrO4>AgI
C. Ag2CrO4>AgCl>AgI D. Ag2CrO4>AgI>AgCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用所给试剂与图示装置能够制取相应气体的是(夹持仪器略)
A | B | C | D |
| |
X中试剂 | 水 | 浓盐酸 | 双氧水 | 碘水 | |
Y中试剂 | Fe | MnO2 | MnO2 | NaBr | |
气体 | H2 | Cl2 | O2 | Br2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向50 mL 0.018 mol·L-1的AgNO3溶液中加入50 mL 0.020 mol·L-1的盐酸,生成沉淀。溶度积为Ksp=c(Ag+)·c(Cl-)=1×10-10,试求(写出简单计算过程):
(1)沉淀生成后溶液中c(Ag+)为_____。
(2)沉淀生成后溶液的pH是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物在生产生活中广泛存在。
(1)氯胺(NH2Cl)的电子式为___。可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如表所示(假定不同物质中同种化学键的键能一样),则上述反应的ΔH=___。
化学键 | N-H | Cl-Cl | N-Cl | H-Cl |
键能/(kJ·mol-1) | 391 | 243 | 191 | 431 |
(2)液氨中存在电离平衡2NH3(l)![]() NH
NH![]() +NH
+NH![]() ,用Pt电极对液氨进行电解也可产生H2和N2。阴极的电极反应式是___。
,用Pt电极对液氨进行电解也可产生H2和N2。阴极的电极反应式是___。
(3)用焦炭还原NO的反应为:2NO(g)+C(s)![]() N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如表所示:
t/min | 0 | 20 | 40 | 60 | 80 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①该反应为___(填“放热”或“吸热”)反应,理由是___;
②下列选项中可以说明容器乙已经达到平衡状态的是___(填序号)
A.容器内压强不变
B.容器内气体的密度不变
C.2υ正(NO)=υ逆(N2)
D.混合气体的平均摩尔质量不变
③乙容器在100min达到平衡状态,则0~100min内用NO的浓度变化表示的平均反应速率υ(NO)=___,平衡常数K(400℃)=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.0.1 mol·L-1 NaHCO3溶液中:NH![]() 、H+、NO
、H+、NO![]() 、SO
、SO![]()
B.使酚酞变红色的溶液中:Mg2+、Fe2+、NO![]() 、Cl-
、Cl-
C.0.1 mol·L-1 FeCl3溶液中:K+、Na+、Br-、SCN-
D.c(H+)=1×10-4 mol·L-1的溶液中:K+、Cu2+、Cl-、SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,Fe2O3和H2反应可转化为Fe3O4,方程式为3Fe2O3+H2![]() 2Fe3O4+H2O。下列说法正确的是( )
2Fe3O4+H2O。下列说法正确的是( )
A.Fe2O3俗名磁性氧化铁
B.该反应条件下H2的还原性强于Fe3O4的还原性
C.每消耗160 g Fe2O3,反应中转移2×6.02×1023个电子
D.Fe3O4可由Fe与H2O在常温下反应制得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式,并分别用双线桥法和单线桥法表示电子转移的方向和数目。
(1)用氢气还原氧化铜。__、__。
(2)加热氯酸钾分解制取氧气。__、__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com