
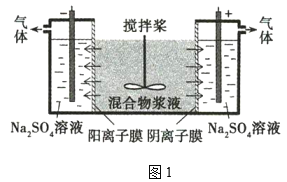
【题目】某混合物浆液含Al(OH)3、MnO2和少量Na2Cr2O4。考虑到胶体的吸附作用使Na2Cr2O4不易完全被水浸出,某研究小组利用设计的电解分离装置(如图1),使浆液分离成固体混合物和含铬元素溶液,并回收利用。
固体混合物的分离和利用的流程图如图2所示(流程图中的部分分离操作和反应条件未标明):
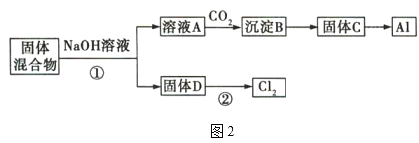
(1)反应①所加试剂NaOH的电子式为___,B→C的反应条件为___,C→Al的制备方法称为___。
(2)该小组探究反应②发生的条件。D与浓盐酸混合,不加热,无变化;加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2。由此判断影响该反应有效进行的因素有___(填序号)。
a.温度 b.Cl-的浓度 c.溶液的酸度
【答案】![]() 加热(或煅烧) 电解法 ac
加热(或煅烧) 电解法 ac
【解析】
在图1中,与电源负极相连的是电解池的阴极,发生反应为2H2O+2e-=2OH-+H2↑,混合物浆液中Na+向阴极移动;与电源正极相连的是电解池的阳极,发生反应为2H2O-4e-=O2↑+4H+,混合物浆液中的Cr2O42-向阳极移动。此时混合物浆液中的物质为Al(OH)3、MnO2。在图2中,固体混合物中加入NaOH溶液,Al(OH)3溶解生成NaAlO2溶液,此为溶液A的主要成分,MnO2为固体D的主要成分。溶液A中通入CO2,与NaAlO2发生反应:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,沉淀B的主要成分为Al(OH)3,受热分解生成Al2O3,成为固体C的主要成分,熔融电解可获得Al。固体D中的MnO2与浓盐酸在加热条件下反应,可制得Cl2。
(1)NaOH为离子化合物,由Na+和OH-构成,电子式为![]() 。根据图2中的转化关系,向溶液A中通入CO2,发生反应:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,沉淀B为Al(OH)3,固体C为Al2O3,B→C的反应条件为加热或煅烧,Al2O3→Al的制备方法为氧化铝的熔融电解法。答案为:
。根据图2中的转化关系,向溶液A中通入CO2,发生反应:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,沉淀B为Al(OH)3,固体C为Al2O3,B→C的反应条件为加热或煅烧,Al2O3→Al的制备方法为氧化铝的熔融电解法。答案为:![]() ;加热或煅烧;电解法;
;加热或煅烧;电解法;
(2)根据“D与浓盐酸混合,不加热,无变化;加热有Cl2生成”知,温度对反应有影响;滴加硫酸,引入H+,又产生Cl2,说明溶液的酸度对反应有影响。答案为:ac。


科目:高中化学 来源: 题型:
【题目】(1)下列物质中,既含离子键又含共价键的化合物是_________;同时存在σ键和π键的分子是_________,含有极性键的非极性分子是_________。
A.N2 B.C2H6 C.CaCl2 D.NH4Cl
(2)用“>”或“<”填空:
晶格能:Na2O_______KCl 酸性:H2SO4_______HClO4 离子半径:Al3+_______F-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里从海藻中提取碘的流程如下图:
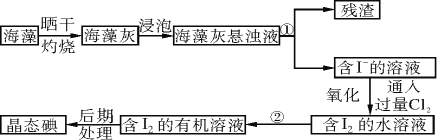
(1)指出制取碘的过程中有关的实验操作名称(或仪器):
①操作名称________________,②仪器________________。
(2)提取碘的过程中,可供选择的有机溶剂是________(填字母序号)。
a.甲苯、酒精 b.四氯化碳、苯
c.汽油、乙酸 d.汽油、甘油
(3)含碘的有机物溶液中提取碘和回收有机溶剂,还需要经过蒸馏,观察下列实验装置指出其错误之处,并指出正确操作。____________________________________。
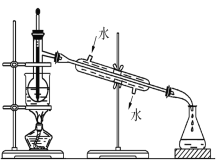
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1是铜锌原电池示意图。图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示( )
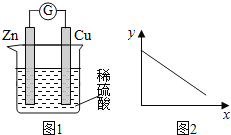
A. 铜棒的质量 B. c(Zn2+) C. c(H+) D. c(SO42-) -
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1L pH=10的NaOH溶液中持续通入CO2。通入的CO2的体积(V)与溶液中水电离出的OH-离子浓度(![]() )的关系如图所示。下列叙述正确的是
)的关系如图所示。下列叙述正确的是
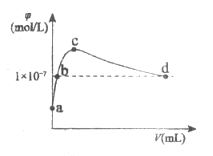
A.a点溶液:水电离的c(OH-)=1×10-4mol/L
B.b点溶液:c(OH-)=c(H+)
C.c点溶液:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
D.d点溶液:c(Na+)>2c(CO32-)+c(HCO3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在 1标准大气压、25℃ 下,1mol 气态 AB 分子生成气态 A 原子和 B 原子的过程中所吸收的能量称为AB间共价键的键能,已知水分子的能量变化关系图如下:

下列说法正确的是
A.△H1<0,且△H3 <△H4
B.△H4 是 O2的键能
C.△H5 =△H1+△H2+△H3+△H4
D.△H3+△H4 >△H5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值。下列说法正确的是( )
A.14g聚丙烯中含C-H键总数目为2NA
B.常温下,pH=13的NaOH溶液中含有的OH-数目为0.1NA
C.100mL12mol·L-1浓硝酸与过量Cu反应转移电子的数目为0.6NA
D.电解精炼铜时,若阳极质量减少64g,则阴极得到电子的数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2O4(g) ![]() 2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法不正确的是
2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法不正确的是
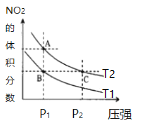
A.A点的反应速率小于C点的反应速率
B.A、C两点气体的颜色:A浅,C深
C.由状态B到状态A,可以用降温的方法
D.A、C两点气体的平均相对分子质量:A<C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列中心原子的杂化轨道类型和分子几何构型不正确的是
A. CCl4中C原子sp3杂化,为正四面体形
B. H2S分子中,S为sp2杂化,为直线形
C. CS2中C原子sp杂化,为直线形
D. BF3中B原子sp2杂化,为平面三角形
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com