
【题目】下列中心原子的杂化轨道类型和分子几何构型不正确的是
A. CCl4中C原子sp3杂化,为正四面体形
B. H2S分子中,S为sp2杂化,为直线形
C. CS2中C原子sp杂化,为直线形
D. BF3中B原子sp2杂化,为平面三角形
科目:高中化学 来源: 题型:
【题目】应对雾霾污染、改善空气质量需要从多方面入手,如开发利用清洁能源。甲醇是一种可再生的清洁能源,具有广阔的开发和应用前景。回答下列问题:
(1)CO2与H2合成甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。但是找到合适的催化剂是制约该方法的瓶颈。目前主要使用贵金属催化剂,但是贵金属储量稀少,成本高昂,难以大规模应用,且使用中存在环境污染的风险。最近采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,该反应历程如图所示。
CH3OH(g)+H2O(g)。但是找到合适的催化剂是制约该方法的瓶颈。目前主要使用贵金属催化剂,但是贵金属储量稀少,成本高昂,难以大规模应用,且使用中存在环境污染的风险。最近采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,该反应历程如图所示。
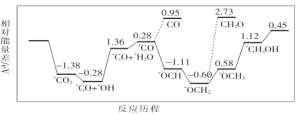
容易得到的副产物有CO和CH2O,其中相对较多的副产物为__;上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中__(填字母)的能量变化。
A.*CO+*OH→*CO+*H2O
B.*CO→*OCH
C.*OCH2→*OCH3
D.*OCH3→*CH3OH
(2)恒压(容器的容积可变)下,0.2molCO2与0.6molH2在催化剂作用下发生反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H,CO2的平衡转化率与温度、压强的关系如图所示。
CH3OH(g)+H2O(g) △H,CO2的平衡转化率与温度、压强的关系如图所示。
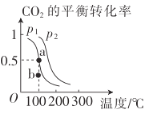
压强p1__(填“<”或“>”)p2。
②在p1、100℃条件下,b点时v正__(填“<"或“>”)v逆。
③已知:反应速率v=v正-v逆=k正![]() ,k正、k逆分别为正、逆反应速率常数,x为物质的量分数,若b点对应的坐标参数为(100,0.4),计算b处的
,k正、k逆分别为正、逆反应速率常数,x为物质的量分数,若b点对应的坐标参数为(100,0.4),计算b处的![]() =__(保留3位有效数字)。
=__(保留3位有效数字)。
(3)焦炭与水蒸气在恒容密闭容器中反应制合成气的主要反应(Ⅰ)、(Ⅱ)的lgKP(KP为以分压表示的平衡常数)与T的关系如图所示。
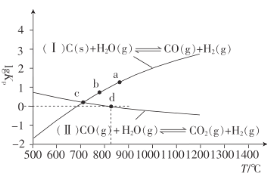
反应(Ⅱ)的△H__(填“大于”“等于”或“小于”)0。
②c点时,反应C(s)+CO2(g)![]() 2CO(g)的KP=__(填数值)。
2CO(g)的KP=__(填数值)。
③在恒容密闭容器中充入0.5molCO、2molH2O(g)只发生反应(Ⅱ),图中d点处达到平衡时,CO的转化率为__;达到平衡时,向容器中再充入0.5molCO、2molH2O(g),重新达到平衡时,CO的平衡转化率__(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年2月《Nature》报道的一种四室(1#~4#)自供电从低浓度废水中回收铜等重金属的装置如下图所示:
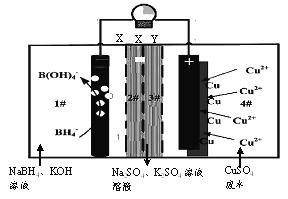
下列说法正确的是
A. 装置工作时,4#室中溶液pH不变
B. X、Y依次为阴离子、阳离子选择性交换膜
C. 负极的电极反应为:BH4-+8OH--8e-=B(OH)4-+4H2O
D. 单位时间内4n(NaBH4)消耗>n(Cu)生成是由于负极上有O2析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是科学界最重要的成就之一。作为一种独特的工具,它使科学家能够预测地球上和宇宙中物质的外观、性质及结构等。
(1)通常制造的农药含元素F、P、S、Cl。四种元素的电负性从大到小的顺序为_______;第一电离能从大到小的顺序为_________。
(2)科学家曾利用元素周期表寻找F、Cl的含碳化合物作为制冷剂。已知CCl4的沸点为76.8℃,CF4的沸点为-128℃,若要求制冷剂沸点介于两者之间,则含一个碳原子的该制冷剂可以是__________(写出其中一种的化学式)。
(3)1963年以来科学家借助射电望远镜,在星际空间已发现NH3、HC≡C-C≡N等近两百种星际分子。与NH3互为等电子体的阳离子为____;HC≡C-C≡N分子中![]() 键与
键与![]() 键的数目比n(
键的数目比n(![]() )∶n(
)∶n(![]() )=__________。
)=__________。
(4)过渡元素(包括稀土元素)中可寻找各种优良催化剂。Sc的一种氢化物的晶胞结构如图所示,该氢化物的化学式为_________。
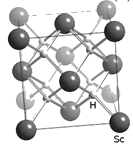
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是金属镁和卤素单质(X2)反应的能量变化示意图。下列说法正确的是
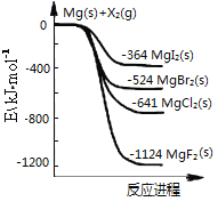
A. 卤素单质(X2)与水反应均可生成两种酸
B. MgF2的电子式为:![]()
C. 热稳定性:MgI2>MgBr2>MgCl2>MgF2
D. 由图可知此温度下MgI2(s)与Cl2(g)反应的热化学方程式为:MgI2(s)+Cl2(g)=MgCl2(s)+I2(g) ΔH=-277 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.铁与氯化铁溶液反应:Fe+Fe3+=2Fe2+
B.氯化铝溶液与过量的氢氧化钠溶液反应:Al3++3OH-=Al(OH)3↓
C.氯气与氢氧化钠溶液反应:Cl2+2OH-=Cl-+ClO-+H2O
D.碳酸氢钠溶液与稀盐酸反应:2H++CO32-=CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在一定体积的密闭容器中进行可逆反应N2(g)+3H2(g)![]() 2NH3(g),下列说法中,能说明该反应已经达到化学平衡状态的是( )
2NH3(g),下列说法中,能说明该反应已经达到化学平衡状态的是( )
A.容器中N2、H2和NH3三种物质共存
B.容器中N2和H2的分子数之比为1:3
C.容器中N2、H2、NH3的浓度相等
D.NH3的生成速率和分解速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证卤素单质氧化性的相对强弱,某小组用如图所示装置进行实验(夹持仪器已略去,气密性已检验)。
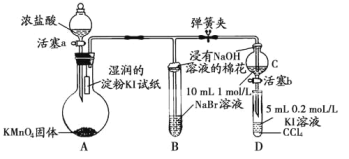
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为红棕色时,关闭活塞a。
Ⅳ.……
(1)A中产生黄绿色气体,其电子式是_____。
(2)验证氯气的氧化性强于碘的实验现象是____。
(3)B中溶液发生反应的离子方程式是______。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是_____。
(5)过程Ⅲ实验的目的是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)元素K的焰色反应呈紫红色,其中紫色对应的辐射波长为_______nm(填标号)。
A.404.4 B.553.5 C.589.2 D.670.8 E.766.5
(2)基态K原子中,核外电子占据的最高能层的符号是_________,占据该能层电子的电子云轮廓图形状为___________。K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cr低,原因是___________________________。
(3)X射线衍射测定等发现,I3AsF6中存在I3+离子。I3+离子的几何构型为_____________,中心原子的杂化形式为________________。
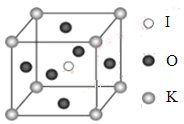
(4)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,边长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为______nm,与K紧邻的O个数为__________。
(5)在KIO3晶胞结构的另一种表示中,I处于各顶角位置,则K处于______位置,O处于______位置。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com