
【题目】一定温度下,在一定体积的密闭容器中进行可逆反应N2(g)+3H2(g)![]() 2NH3(g),下列说法中,能说明该反应已经达到化学平衡状态的是( )
2NH3(g),下列说法中,能说明该反应已经达到化学平衡状态的是( )
A.容器中N2、H2和NH3三种物质共存
B.容器中N2和H2的分子数之比为1:3
C.容器中N2、H2、NH3的浓度相等
D.NH3的生成速率和分解速率相等
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】H2C2O4为二元弱酸,25℃时,Ka1=5.4×10-2,Ka2=5.4×10-5。下列说法正确的是
A. 0.1mol/LNaHC2O4溶液中:c(H2C2O4)>c(C2O42-)
B. 反应HC2O4-+OH-![]() C2O42-+H2O的平衡常数K=5.4×1012
C2O42-+H2O的平衡常数K=5.4×1012
C. 0.1mol/LNa2C2O4溶液中:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4)
D. pH=7的NaHC2O4与Na2C2O4的混合溶液中:c(Na+)=c(HC2O4-)+c(C2O42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列中心原子的杂化轨道类型和分子几何构型不正确的是
A. CCl4中C原子sp3杂化,为正四面体形
B. H2S分子中,S为sp2杂化,为直线形
C. CS2中C原子sp杂化,为直线形
D. BF3中B原子sp2杂化,为平面三角形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向A、B、C和D四支试管中的溶液分别进行表中的操作,通过观察到的实验现象得出的结论正确的是( )
操作 | 现象 | 结论 | |
A | ①滴加稀HNO3 ②滴加BaCl2溶液 | 无明显现象白色沉淀 | 原溶液一定含SO |
B | 滴加稀盐酸 | 有大量气泡产生 | 原溶液一定含CO |
C | ①滴加稀HCl ②滴加AgNO3溶液 | 无明显现象白色沉淀 | 原溶液一定含Cl- |
D | ①加KSCN溶液 ②滴加氯水 | 无明显现象溶液呈红色 | 原溶液一定含Fe2+ |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠晶体(Na2S2O3·5H2O)又称海波,呈无色透明状,易溶于水,不溶于乙醇,常用作棉织物漂白后的脱氯剂、定量分析中的还原剂。
Ⅰ. Na2S2O3·5H2O的制备
Na2S2O3·5H2O的制备方法有多种,其中亚硫酸钠法是工业和实验室中的主要方法:Na2SO3 + S + 5H2O ![]() Na2S2O3·5H2O
Na2S2O3·5H2O
制备过程如下:
①称取12.6g Na2SO3于100mL烧杯中,加50 mL去离子水搅拌溶解。
②另取4.0 g硫粉于200mL烧杯中,加6 mL乙醇充分搅拌均匀将其润湿,再加入Na2SO3溶液,隔石棉小火加热煮沸,不断搅拌至硫粉几乎全部反应。
③停止加热,待溶液稍冷却后加2 g活性炭,加热煮沸2分钟(脱色)。
④趁热过滤,得滤液至蒸发皿中, ______________、____________________。
⑤过滤、洗涤,用滤纸吸干后,称重,计算产率。
(1)加入的硫粉用乙醇润湿的目的是____________________________。
(2)步骤④趁热过滤的原因_____________________,空格处应采取的操作是_________________、____________________。
(3)步骤⑤洗涤过程中,为防止有部分产品损失,应选用的试剂为___________。
(4)滤液中除Na2S2O3和未反应完全的Na2SO3外,最可能存在的无机杂质是________________,生成该杂质的原因可能是____________________________。
Ⅱ.产品纯度的测定
准确称取1.00 g产品(硫代硫酸钠晶体的摩尔质量为248 g/mol),用适量蒸馏水溶解,以淀粉作指示剂,用0.1000 mol/L碘标准溶液滴定至终点,消耗21.00 mL。反应的离子方程式为:2S2O32-+I2=S4O62-+2I-。
(5)计算所得产品的纯度为___________(保留三位有效数字),该数据的合理解释可能是__________(不考虑实验操作引起的误差)。
Ⅲ.产品的应用
(6)Na2S2O3常用于脱氯剂,在溶液中易被Cl2氧化为SO42-,该反应的离子方程式为 ____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列甲、乙、丙是常见的有机化合物,按要求回答下列问题:
甲:CH3CH=CH2 乙:![]() 丙:HOCH2CH2CH2COOH
丙:HOCH2CH2CH2COOH
(1)甲的名称是_______。
(2)甲能与溴的四氯化碳溶液反应,反应的化学方程式为______。
(3)甲也能发生聚合反应,产物的结构简式为_____________。
(4)丙与浓硫酸混合加热,生成五元环物质的化学反应方程式是____________。
(5)写出乙的同分异构体中,含苯环的且核磁共振氢谱有2组峰,峰面积比为3∶2的结构简式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,金属相互化合形成的化合物称为金属互化物,如Cu9Al4、Cu5Zn8等。
(1)某金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于________(填“晶体”或“非晶体”)。
(2)基态铜原子有________个未成对电子;Cu2+的电子排布式为____________________;在CuSO4溶液中加入过量氨水,充分反应后加入少量乙醇,析出一种深蓝色晶体,该晶体的化学式为____________________,其所含化学键有____________________,乙醇分子中C原子的杂化轨道类型为________。
(3)铜能与类卤素(SCN)2反应生成Cu(SCN)2,1 mol(SCN)2分子中含有σ键的数目为________。(SCN)2对应的酸有硫氰酸(H—S—C≡N)、异硫氰酸(H—N===C===S)两种。理论上前者沸点低于后者,其原因是______________________________________________________________________________________。

(4)ZnS的晶胞结构如图所示,在ZnS晶胞中,S2-的配位数为_______________。
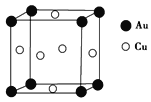
(5)铜与金形成的金属互化物的晶胞结构如图所示,其晶胞边长为a nm,该金属互化物的密度为________ g·cm-3(用含a、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,向![]() 恒容密闭容器中充入
恒容密闭容器中充入![]() ,发生反应
,发生反应![]() 。反应过程中
。反应过程中![]() 随时间变化的曲线如图所示,下列说法不正确的是( )
随时间变化的曲线如图所示,下列说法不正确的是( )
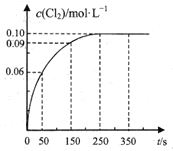
A.反应在![]() 的平均速率
的平均速率![]()
B.该温度下,反应的平衡常数值![]()
C.保持其他条件不变,升高温度,若平衡时![]() ,则该反应的
,则该反应的![]()
D.反应达平衡后,再向容器中充入![]() ,该温度下再达到平衡时,
,该温度下再达到平衡时,![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com