
【题目】H2C2O4为二元弱酸,25℃时,Ka1=5.4×10-2,Ka2=5.4×10-5。下列说法正确的是
A. 0.1mol/LNaHC2O4溶液中:c(H2C2O4)>c(C2O42-)
B. 反应HC2O4-+OH-![]() C2O42-+H2O的平衡常数K=5.4×1012
C2O42-+H2O的平衡常数K=5.4×1012
C. 0.1mol/LNa2C2O4溶液中:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4)
D. pH=7的NaHC2O4与Na2C2O4的混合溶液中:c(Na+)=c(HC2O4-)+c(C2O42-)
【答案】C
【解析】
A.0.1mol/LNaHC2O4溶液中,HC2O4-存在水解平衡:HC2O4-+H2O![]() H2C2O4+OH-,水解平衡常数Kh=
H2C2O4+OH-,水解平衡常数Kh=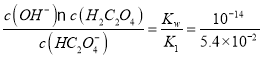 =1.8×10-13< Ka2,水解小于电离,所以NaHC2O4溶液显酸性,因此c(H2C2O4)<c(C2O42-),A错误;
=1.8×10-13< Ka2,水解小于电离,所以NaHC2O4溶液显酸性,因此c(H2C2O4)<c(C2O42-),A错误;
B.反应HC2O4-+OH-![]() C2O42-+H2O的电离平衡常数在25℃时K=5.4×10-5,B错误;
C2O42-+H2O的电离平衡常数在25℃时K=5.4×10-5,B错误;
C.Na2C2O4是强碱弱酸盐,其水溶液显碱性,根据质子守恒可得:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4),C正确;
D. pH=7的NaHC2O4与Na2C2O4的混合溶液中,根据电荷守恒可得:c(H+)+c(Na+)=c(HC2O4-)+2c(C2O42-)+c(OH-),由于c(H+)=c(OH-),所以c(Na+)=c(HC2O4-)+2c(C2O42-),D错误;
故合理选项是C。


科目:高中化学 来源: 题型:
【题目】钕铁硼磁铁是目前为止具有最强磁力的永久磁铁。生产钕铁硼磁铁的主要原材料有稀土金属钕、高纯铁、铝、硼等。回答下列问题:
(1)钕(Nd)为60号元素,在周期表中位于第_________周期。基态硼原子中占据最高能级的电子,电子云轮廓图形状为_______。铁离子的电子排布式__________________
(2)实验测得AlCl3的实际存在形式为Al2Cl6,其分子的球棍模型如下图所示:
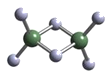
① 分子中A1原子采取____杂化。Al2Cl6属于____分子(填“极性”或“非极性”)。
②AlCl3与过量NaOH溶液反应生成Na[Al(OH)4],[A1(OH)4]-中存在的化学键有_________(填选项字母)。
A.离子键 B.共价键 C.配位键 D.金属键 E.氢键
(3)工业上可用电解熔融的FeO、Fe2O3冶炼高纯铁。基态Fe2+的价电子排布图(轨道表达式)为______________;用物质结构知识说明Fe2+容易被氧化成Fe3+的原因:________________________。
(4)氮化铁晶体的晶胞结构如图1所示。该晶体中铁、氮的微粒个数之比为_____。
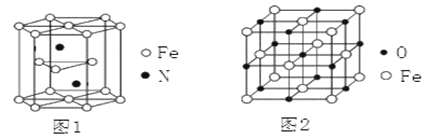
(5)氧化亚铁晶体的晶胞如图2所示。已知:氧化亚铁晶体的密度为ρg·cm—3,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为_________;Fe2+与O2—的最短核间距为_____________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年2月《Nature》报道的一种四室(1#~4#)自供电从低浓度废水中回收铜等重金属的装置如下图所示:
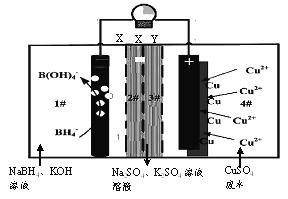
下列说法正确的是
A. 装置工作时,4#室中溶液pH不变
B. X、Y依次为阴离子、阳离子选择性交换膜
C. 负极的电极反应为:BH4-+8OH--8e-=B(OH)4-+4H2O
D. 单位时间内4n(NaBH4)消耗>n(Cu)生成是由于负极上有O2析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种短周期元素,相关信息如下表。
元素 | 相关信息 |
A | 气态氢化物极易溶于水,可用作制冷剂 |
B | 单质的焰色反应为黄色 |
C | 单质是黄绿色气体,可用于自来水消毒 |
D | –2价阴离子的结构示意图是 |
请根据表中信息回答:
(1) A在周期表中的位置______。
(2) B与C形成化合物的类型为______(填“离子化合物”或“共价化合物”)
(3) 最高价氧化物对应的水化物的酸性C强于D,请用原子结构解释原因______。
(4) 已知硒(Se) 与D同主族,且位于D下一个周期,根据硒元素在元素周期表中的位置推测,硒可能具有的性质是______。
a.非金属性比D元素的强
b.SeO2既有氧化性又有还原性
c.最高价氧化物对应的水化物的化学式为H2SeO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是科学界最重要的成就之一。作为一种独特的工具,它使科学家能够预测地球上和宇宙中物质的外观、性质及结构等。
(1)通常制造的农药含元素F、P、S、Cl。四种元素的电负性从大到小的顺序为_______;第一电离能从大到小的顺序为_________。
(2)科学家曾利用元素周期表寻找F、Cl的含碳化合物作为制冷剂。已知CCl4的沸点为76.8℃,CF4的沸点为-128℃,若要求制冷剂沸点介于两者之间,则含一个碳原子的该制冷剂可以是__________(写出其中一种的化学式)。
(3)1963年以来科学家借助射电望远镜,在星际空间已发现NH3、HC≡C-C≡N等近两百种星际分子。与NH3互为等电子体的阳离子为____;HC≡C-C≡N分子中![]() 键与
键与![]() 键的数目比n(
键的数目比n(![]() )∶n(
)∶n(![]() )=__________。
)=__________。
(4)过渡元素(包括稀土元素)中可寻找各种优良催化剂。Sc的一种氢化物的晶胞结构如图所示,该氢化物的化学式为_________。
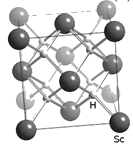
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是金属镁和卤素单质(X2)反应的能量变化示意图。下列说法正确的是
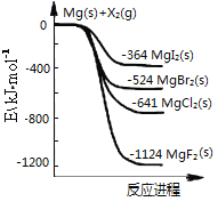
A. 卤素单质(X2)与水反应均可生成两种酸
B. MgF2的电子式为:![]()
C. 热稳定性:MgI2>MgBr2>MgCl2>MgF2
D. 由图可知此温度下MgI2(s)与Cl2(g)反应的热化学方程式为:MgI2(s)+Cl2(g)=MgCl2(s)+I2(g) ΔH=-277 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在一定体积的密闭容器中进行可逆反应N2(g)+3H2(g)![]() 2NH3(g),下列说法中,能说明该反应已经达到化学平衡状态的是( )
2NH3(g),下列说法中,能说明该反应已经达到化学平衡状态的是( )
A.容器中N2、H2和NH3三种物质共存
B.容器中N2和H2的分子数之比为1:3
C.容器中N2、H2、NH3的浓度相等
D.NH3的生成速率和分解速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
A. 0.1 mol 的![]() 中,含有
中,含有![]() 个中子
个中子
B. pH=1的H3PO4溶液中,含有![]() 个
个![]()
C. 2.24L(标准状况)苯在O2中完全燃烧,得到![]() 个CO2分子
个CO2分子
D. 密闭容器中1 mol PCl3与1 mol Cl2反应制备 PCl5(g),增加![]() 个P-Cl键
个P-Cl键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com