
【题目】T℃时,向![]() 恒容密闭容器中充入
恒容密闭容器中充入![]() ,发生反应
,发生反应![]() 。反应过程中
。反应过程中![]() 随时间变化的曲线如图所示,下列说法不正确的是( )
随时间变化的曲线如图所示,下列说法不正确的是( )
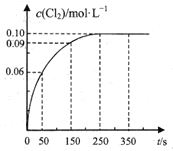
A.反应在![]() 的平均速率
的平均速率![]()
B.该温度下,反应的平衡常数值![]()
C.保持其他条件不变,升高温度,若平衡时![]() ,则该反应的
,则该反应的![]()
D.反应达平衡后,再向容器中充入![]() ,该温度下再达到平衡时,
,该温度下再达到平衡时,![]()
【答案】D
【解析】
A.由图可知,0~50s 内Cl2的浓度变化量为0.06mol/L,![]() ,A正确;
,A正确;
B.由图可知,250s时达到平衡,平衡时c(Cl2)=0.10mol/L,则:

该温度下平衡常数![]() ,B正确;
,B正确;
C.平衡时c(PCl3)=0.10mol/L,保持其他条件不变,升高温度,平衡时c′(PCl3)=0.11mol/L,浓度增大,平衡向正反应移动,该反应正反应为吸热反应,△H>0,C正确;
D.反应达平衡后,再向容器中充入 1mol PCl5,相当于增大压强,平衡向逆反应方向进行,与原平衡相比PCl5转化率降低,达到平衡时0.1mol/L<c(Cl2)<0.2mol/L,D错误;
故答案为:D。


科目:高中化学 来源: 题型:
【题目】一定温度下,在一定体积的密闭容器中进行可逆反应N2(g)+3H2(g)![]() 2NH3(g),下列说法中,能说明该反应已经达到化学平衡状态的是( )
2NH3(g),下列说法中,能说明该反应已经达到化学平衡状态的是( )
A.容器中N2、H2和NH3三种物质共存
B.容器中N2和H2的分子数之比为1:3
C.容器中N2、H2、NH3的浓度相等
D.NH3的生成速率和分解速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
A. 0.1 mol 的![]() 中,含有
中,含有![]() 个中子
个中子
B. pH=1的H3PO4溶液中,含有![]() 个
个![]()
C. 2.24L(标准状况)苯在O2中完全燃烧,得到![]() 个CO2分子
个CO2分子
D. 密闭容器中1 mol PCl3与1 mol Cl2反应制备 PCl5(g),增加![]() 个P-Cl键
个P-Cl键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)元素K的焰色反应呈紫红色,其中紫色对应的辐射波长为_______nm(填标号)。
A.404.4 B.553.5 C.589.2 D.670.8 E.766.5
(2)基态K原子中,核外电子占据的最高能层的符号是_________,占据该能层电子的电子云轮廓图形状为___________。K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cr低,原因是___________________________。
(3)X射线衍射测定等发现,I3AsF6中存在I3+离子。I3+离子的几何构型为_____________,中心原子的杂化形式为________________。
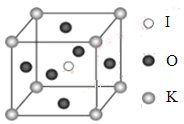
(4)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,边长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为______nm,与K紧邻的O个数为__________。
(5)在KIO3晶胞结构的另一种表示中,I处于各顶角位置,则K处于______位置,O处于______位置。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )
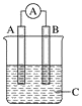
A. A是Zn,B是Cu,C为稀硫酸
B. A是Cu,B是Zn,C为稀硫酸
C. A是Fe,B是Ag,C为稀AgNO3溶液
D. A是Ag,B是Fe,C为稀AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.电解精炼铜时,阳极泥中含有![]() 等金属
等金属
B.![]() 通入足量水中,转移电子的数目为
通入足量水中,转移电子的数目为![]()
C.反应![]() 在常温下不能自发进行,说明该反应的
在常温下不能自发进行,说明该反应的![]()
D.等质量的硫蒸气和硫粉分别在空气中完全燃烧,前者放出热量多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组从富含 NaBr 的工业废水中提取Br2 的过程主要包括:氧化、萃取、分液、蒸馏等步骤。
已知:①蒸馏时各组分的沸点差异越大,分离效果越好;②可能用到的数据信息和装置如下:
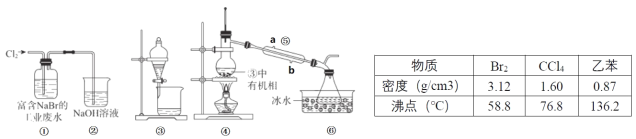
下列说法错误的是
A.②的作用是吸收多余 Cl2,防止空气污染
B.用③进行萃取时,选择乙苯比 CCl4 更合理
C.乙苯和 CCl4 萃取 Br2 时现象相同,都是分层,上层无色,下层橙色
D.仪器⑤的名称为冷凝管,其中 b 为进水口,a 为出水口
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 正四面体烷![]() 与立方烷
与立方烷![]() 的二氯代物数目相同
的二氯代物数目相同
B. 淀粉的水解产物为葡萄糖,葡萄糖在酒化酶作用下再进一步水解可得酒精
C. 75%的乙醇溶液可用于医疗消毒,福尔马林可用于浸制动物标本,二者都使蛋白质变 性
D. 甘氨酸和丙氨酸混合物发生缩合只能形成 2 种二肽
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】学习小组探究AgNO3、Ag2O(棕黑色固体,难溶于水)对氯水漂白性的影响。
实验记录如下:
| 实验 | 方案和现象 |
ⅰ | 加入1mL蒸馏水,再滴加1滴品红溶液,品红溶液较快褪色 | |
ⅱ | 加入少量Ag2O固体,产生白色沉淀a。再加入1mL蒸馏水和 1滴品红溶液,品红溶液褪色比i快 | |
ⅲ | 加入1mL较浓AgNO3溶液,产生白色沉淀b。再滴加1滴品红溶液,品红溶液褪色比i慢 |
(1)用离子方程式表示i中品红溶液褪色的原因:______。
(2)经检验,ii中的白色沉淀a是AgCl。产生AgCl的化学方程式是_______。
(3)ⅰ是iii的对比实验,目的是排除iii中______造成的影响。
(4)研究白色沉淀b的成分。进行实验iv(按实验iii的方案再次得到白色沉淀b,过滤、洗涤,置于试管中):
实验iv:
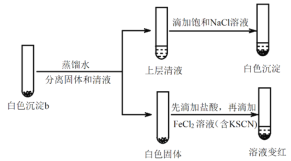
①设计对比实验证实白色沉淀b不只含有AgCl,实验方案和现象是_______。
②FeCl2溶液的作用是_______。由此判断,白色沉淀b可能含有AgClO。
(5)进一步研究白色沉淀b和实验iii品红溶液褪色慢的原因,进行实验v:
实验v:

①结合离子方程式解释加入饱和NaCl溶液的目的:_______。
②推测品红溶液褪色的速率:实验iii比实验v______(填“快”或 “慢”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com