
最近,科学家研制出一种纸质电池,这种“软电池”采用薄层纸片作为载体和传导体,在一边附着锌,在另一边附着二氧化锰。电池总反应式为Zn+2MnO2+H2O=ZnO+2MnO(OH)。下列说法正确的是( )
A.该电池中Zn为负极,发生还原反应
B.该电池的正极反应式为MnO2+e-+H2O=2MnOOH+OH-
C.导电时外电路电子由Zn流向MnO2,内电路电子由MnO2流向Zn
D.电池工作时内电路中OH-移动向MnO2一极
科目:高中化学 来源:2016-2017学年黑龙江哈尔滨六中高一上期末化学卷(解析版) 题型:选择题
为确定下列置于空气中的物质是否变质,所选检验试剂(括号内物质)不能达到目的的是( )
A. NaOH溶液[Ba(OH)2溶液]
B. FeSO4溶液(KSCN溶液)
C. KI(淀粉溶液)
D. Na2SO3溶液(BaCl2溶液)
查看答案和解析>>
科目:高中化学 来源:2017届贵州省高三上联考四化学试卷(解析版) 题型:实验题
某校课外探究小组欲在实验室条件下制取少量纯净的无水氯化铝。查阅到以下资料:无水氯化铝是白色晶体,易吸收水分,常压下在177.8 ℃升华,遇潮湿空气即产生大量白雾。用于有机合成和石油工业的催化剂,以及用于处理润滑油等。他们设计了以下装置,请结合题意回答问题:
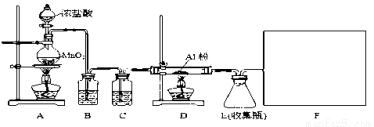
(1)A装置中发生反应的化学方程式为:_________________________
(2)装置B的作用是__________________________
(3)请给标记为F的实线方框选择合适的装置_______
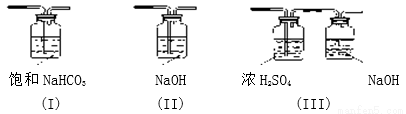
(4)AlCl3遇潮湿空气即产生大量白雾的原因是_________________(结合化学方程式说明)。
(5)制备反应会因盐酸浓度下降而停止,为测定反应残余液中盐酸的浓度,该小组同学提出酸碱中和滴定法测定方案。方案如下:首先准确量取残余清液稀释一定的倍数后作为试样,平行做了4次滴定。实验中所用NaOH溶液浓度为0.2000 mol·L-1,以下是实验记录与数据处理(不考虑NaOH与残液中其他成分的反应)。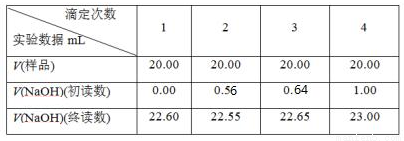
①若本实验需要NaOH标准溶液80mL,则配制该标准溶液需要用到玻璃仪器有玻璃棒,烧杯_______
②经计算,该次滴定测的试样中盐酸浓度为_______________mol·L-1。
③在本实验的滴定过程中,下列操作会使实验结果偏小的是___________(填写序号)。
A.开始滴定时滴定管尖嘴处留有气泡,滴定结束气泡消失
B.未用标准NaOH溶液润洗滴定管
C.锥形瓶中加入待测盐酸后,再加少量水
D. 锥形瓶在滴定时剧烈摇动,有少量液体溅出
锥形瓶在滴定时剧烈摇动,有少量液体溅出
e.滴定前锥形瓶用待测盐酸润洗
f.观察读数时,滴 定前仰视,滴定后俯视
定前仰视,滴定后俯视
查看答案和解析>>
科目:高中化学 来源:2017届贵州省高三模拟四化学卷(解析版) 题型:选择题
镓(Ga)与铝同主族,曾被称为“类铝”,其氧化物和氢氧化物均为两性化合物。工业制备镓的流程如下图所示:
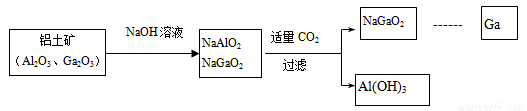
下列判断不合理的是:
A. Al、Ga均处于IIIA族
B. Ga2O3可与盐酸反应生成GaCl3
C. Ga(OH)3可与NaOH反应生成NaGaO2
D. 碱性:Al(OH)3>Ga(OH)3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高二上期中化学卷(解析版) 题型:填空题
常温下,将某一元素酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合后溶液的pH |
甲 | 0.2 | 0.2 | pH=a |
乙 | C1 | 0.2 | pH=7 |
丙 | 0.1 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=9 |
请回答下列问题:
(1)不考虑其他组的结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HA是强酸还是弱酸?
(2)不考虑其他组的结果,单从乙组情况分析,c1是否一定等于0.2mol·L-1?
填(“是”或“否”)。混合溶液中c(A-)与c(Na+)离子浓度的大小关系是 (填序号)
A.前者大 B.后者大 C.一样大 D.无法判断
(3)从丙组结果分析,HA是 酸(“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是 。
(4)丁组实验所得混合溶液中由水电离出的中c(OH-)= mol·L-1。写出该混合溶液中下列算式的精确结果(不能做近似计算)c(Na+)-c(A-)= mol·L-1。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高二上期中化学卷(解析版) 题型:选择题
常温下,将pH=10的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH随溶液体积变化的曲线如图所示,则下列叙述中不正确的是( )
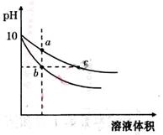
A.a、b两点溶液的导电能力不相同
B.a、b、c三点溶液中水的电离程度a>c>b
C.c点溶液中c(H+)+c(CH3COOH)=c(OH-)
D.若向上述两种溶液中分别加入相同浓度的盐酸至pH=7,则消耗盐酸体积相同
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高二上期中化学卷(解析版) 题型:选择题
在加入铝粉能产生氢气的溶液中,下列各组离子可能大量共存的是( )
A.Na+、 Ba2+、Cl-、NO3-
B. Fe2+、 K+、NO3-、Cl-
C.Na+、NH4+、AlO2-、 SO42-
D.NH4+、ClO-、SO42-、Na+
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上月考五化学试卷(解析版) 题型:填空题
“神十搭载的长征F改进型火箭推进剂之一为无色气体N2O4,N2O4与NO2转换的热化学方程式为:N2O4(g) 2NO2(g) △H=+24.4KJ/mol
2NO2(g) △H=+24.4KJ/mol
(1)将一定量N2O4投入固定容积的真空容器中,下述现象能说明反应达到平衡的是 。
a. v正(N2O4)=2v逆(NO2) b.体系颜色不变
v正(N2O4)=2v逆(NO2) b.体系颜色不变
c.气体平均相对分子质量不变 d.气体密度不变
达到平衡后,保持体积不变升高温度,再次到达平衡时,则混合气体颜色 (填“变深”、“变浅”或“不变”),判断理由 。
(2)T℃时,向1L恒容密闭容器中投入1molCH4和1molH2O(g),发生反应:CH4(g)+H2O(g) CO(g)+3H2(g),经过3min,反应达到平衡。已知平衡时c(CH4
CO(g)+3H2(g),经过3min,反应达到平衡。已知平衡时c(CH4 )=0.5mol/L
)=0.5mol/L
①0~3min内,该反应的平均反应速率v(H2)=____________。
②T℃时,该反应的平衡常数K=___________。
(3)在一定条件下用CO和H2可以制得甲醇,CH3OH和C O的燃烧热为别725.8 kJ/mol ,283.0 kJ/mol,1 mol液态水变成气态水吸热44.0 kJ,写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式: 。
O的燃烧热为别725.8 kJ/mol ,283.0 kJ/mol,1 mol液态水变成气态水吸热44.0 kJ,写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式: 。
(4)工业上用CO与H2在催化剂作用下合成CH3OH,其反应为:CO(g)+2H2(g) CH3OH(g)。按n(CO) : n(H2)=1 : 2向密闭容器中充入反应物,测得平衡时混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。
CH3OH(g)。按n(CO) : n(H2)=1 : 2向密闭容器中充入反应物,测得平衡时混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。
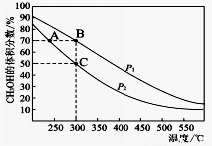
P1_________P2(填“<”“>”或“=”)
②在C点时,CO转化率为____________。
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上段考三化学试卷(解析版) 题型:实验题
硫酸亚铁是一种重要的化工产品,在工业上有重要的用途。某校化学兴趣小组,利用工业烧渣为原料,设计如下制备硫酸亚铁的方案。学生探究烧渣(主要成分为铁的氧化物及少量FeS、SiO2 等)制备绿矾(FeSO4·7H2O)。工艺流程如下所示:
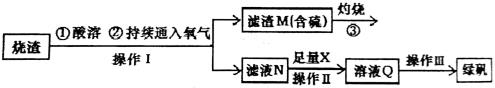
(1)烧渣在进行酸溶时用到了稀硫酸。他们在配制所需的稀硫酸时使用了自来水,有同学提出自来水中含有少量的Cl-,会影响到制出的FeSO4 的纯度。请你设计实验证明已配制的稀硫酸中混有Cl-。
_______________________。
(2)过程③灼烧时产生的气体通入下列溶液中, 溶液不会褪色的是___________
溶液不会褪色的是___________
A.品红溶液 B.紫色石蕊溶液 C.酸性KMnO4溶液 D.红色的酚酞试液
(3)X 是 , 此时滤液N 中发生反应的离子方程式为 。检验溶液Q 中含有的金属阳离子的实验方法是 。
(4)操作III 的操作步骤为蒸发浓缩、 、过滤( 填操作名称)、  、干燥。
、干燥。
(5)硫酸亚铁可以用于治疗缺铁性贫血症,某严重贫血患者共需补充2.8g铁元素,服用的药品中相当于需要绿矾的质量为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com