
设阿伏伽德罗常数的值为NA,下列结论错误的是
A、完全电解2molH2O断裂的σ键键数为4NA
B、标准状况下,11.2LCO2中含有的π键键数为2 NA
C、60gSiO2晶体中含有的Si—O键键数为4NA
D、12g金刚石中含有C—C键键数为2NA
科目:高中化学 来源: 题型:
0.25 mol A的质量是16 g,A的相对分子质量(或相对原子质量)是( )
A.32 g·mol―1 B.64 g·mol―1 C.32 D.64
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关摩尔的使用正确的是( )
| A.1mol O的质量为16g·mol-1 |
| B.0.5mol He约含有6.02×1023个电子 |
| C.2H既表示2个氢原子又表示2mol氢原子 |
| D.每摩尔物质均含有6.02×1023个原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,体积、物质的量浓度均相等的四种溶液:
①盐酸;②醋酸;③氨水;④CH3COONa溶液。下列说法正确的是
A.将①与②分别稀释相同倍数后溶液的pH:①>②
B.若②与③混合后溶液呈中性,则在常温下 Ka(CH3COOH)= Kb(NH3.NH3)
C.③与④中已电离的水分子的数目相等
D.②与④混合所得溶液显酸性,则:c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
元素的性质呈周期性变化的根本原因是
A、原子半径呈周期性变化
B、元素的化合价呈周期性变化
C、第一电离能呈周期性变化
D、元素原子的核外电子排布呈周期性变化
查看答案和解析>>
科目:高中化学 来源: 题型:
周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子。回答下列问题:
(1)b、c、d中第一电离能最大的是 (填元素符号),e的价层电子排布式为 。
(2)a和上述元素中的一种元素形成的共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为 ;上述元素形成的分子中既含有极性共价键、又含有非极性共价键的化合物是 (填化学式)。
(3)这些元素形成的含氧酸中,酸根中的中心原子的价层电子对数为3的酸是 ;酸根呈三角锥形结构的酸是 。(均填化学式)
(4)e和c形成的一种离子化合物的晶体的晶胞结构(图1),则e的化合价为 。
(5)这5种元素形成的一种阴阳离子数比为1:1的离子化合物中,阴离子呈四面体结构;阳离子呈狭长的八面体结构(图2)。该化合物中阴离子为 ,阳离子中存在的化学键类型有 。
(6)根据e晶胞结构(图3),e晶胞中每个e原子周围距离最近的e原子数目为 。
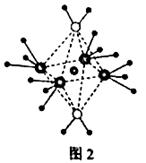
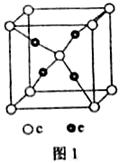
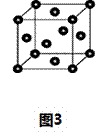 |
查看答案和解析>>
科目:高中化学 来源: 题型:
将某些化学知识用数轴表示,具有直观形象、简明易记的优点。下列用数轴表示的化学知识中不正确的是( )
A.分散系的分类: 
B.AlCl3和NaOH溶液反应后铝元素的存在形式: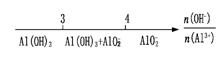
C.常温下甲基橙的变色范围: 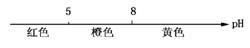
D.CO2与NaOH溶液反应的产物: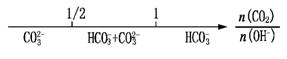
查看答案和解析>>
科目:高中化学 来源: 题型:
对于某些离子的检验及结论中一定正确的是( )








A.加入稀盐酸产生无色无味气体,将气体通入澄清石灰水中,溶液变浑浊,则一定有CO32-
B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,则一定有SO42-
C.分别含有Mg2+、Cu2+和Na+的三种盐酸盐溶液,用NaOH溶液就能一次鉴别开
D.加入碳酸钠溶液产生白色沉淀,再加盐酸,白色沉淀消失,一定有Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
现有三个氧化还原反应:
(1)2FeCl3+2KI==2FeCl2+2KCl+I2
(2)2FeCl2+Cl2==2FeCl3
(3)2KMnO4+16HCl (浓)==2KCl+2MnCl2+8H2O+5Cl2↑
若某溶液中有Fe2+和I―共存,要除去I―而又不影响Fe2+和Cl―,可加入的试剂是( )。
A.Cl2 B.FeCl3 C.KMnO4 D.HCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com