
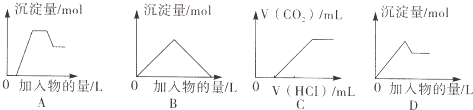
| A、图A表示向含H+、Mg2+、Al3+、NH4+的溶液中滴加NaOH溶液产生沉淀摄的关系曲线 |
| B、图B表示向澄清石灰水中通入二氧化碳直至过量产生沉淀量的关系曲线 |
| C、图C表示向NaOH和Na2CO3的混合液中滴加盐酸产生CO2气体的关系曲线 |
| D、图D表示向明矾溶液中滴加Ba(OH)2溶液产生沉淀最的关系曲线 |


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:
| A、向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O═Fe(OH)3↓+3H+ |
| B、用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O |
| C、将氯气通入NaOH溶液中制取84消毒液:2Cl2+2OH-=ClO-+3Cl-+H2O |
| D、向Na2O2固体中滴加水:Na2O2+H2O=2Na++2OH-+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、O2、O3互为同位素 |
| B、乙烷、乙烯互为同分异构体 |
| C、正丁烷和异丁烷互为同系物 |
| D、1H、2H、3H、H+、H2是氢元素形成的五种不同粒子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AgCl(s)?Ag+(aq)+Cl-(aq) |
| B、Na2S═2Na++S2- |
| C、Ag2S(s)?2Ag+(aq)+S2-(aq) |
| D、PbI2(s)?Pb2+(aq)+2I-(aq) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量吸收液于试管中,滴加3moL.L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中. | |
| 步骤2: | |
| 步骤3: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com