
| ||
| ||
| ||
0.1000×25×10 -3×
| ||
| 1.0 |


科目:高中化学 来源: 题型:
| A、浓烟主要是由生成的大量NH4Cl造成的 |
| B、以上物质的水解都生成对应的酸和碱 |
| C、CCl4和SiCl4的分子结构相似,故CCl4也容易发生水解 |
| D、NH3属于弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
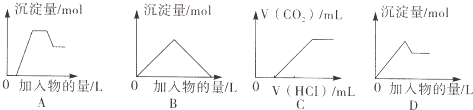
| A、图A表示向含H+、Mg2+、Al3+、NH4+的溶液中滴加NaOH溶液产生沉淀摄的关系曲线 |
| B、图B表示向澄清石灰水中通入二氧化碳直至过量产生沉淀量的关系曲线 |
| C、图C表示向NaOH和Na2CO3的混合液中滴加盐酸产生CO2气体的关系曲线 |
| D、图D表示向明矾溶液中滴加Ba(OH)2溶液产生沉淀最的关系曲线 |
查看答案和解析>>
科目:高中化学 来源: 题型:
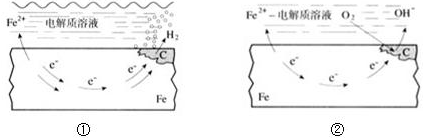
| A、碳表面发生氧化反应 |
| B、钢铁被腐蚀的最终产物为FeO |
| C、生活中钢铁制品的腐蚀以图①所示为主 |
| D、图②中,正极反应式为O2+4e-+2H2O═4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操 作 | 现 象 | 结 论 | |
| (1) | 取少量该溶液于试管中, 滴加无色酚酞溶液 | 该溶液显碱性 | |
| (2) | 另取少量该溶液于试管中,滴加稀盐酸 | 有气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、XYZW的原子半径依次减小 |
| B、W与Y形成的化合物中可能含有共价键 |
| C、W的气态氢化物的沸点一定高于Z的气态氢化物的沸点 |
| D、若W与X的原子序数相差5,则二者形成化合物的化学式一定为X2W3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若X的原子序数是m,则Y的原子序数必定是m±4 |
| B、XY3一定属于离子化合物 |
| C、X与Y可属于两个不同周期,也可属于同一周期 |
| D、X的原子半径小于Y的原子半径 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com