
| A、浓烟主要是由生成的大量NH4Cl造成的 |
| B、以上物质的水解都生成对应的酸和碱 |
| C、CCl4和SiCl4的分子结构相似,故CCl4也容易发生水解 |
| D、NH3属于弱电解质 |


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
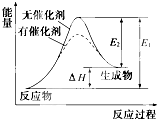 某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )
某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )| A、催化剂能改变该反应的焓变 |
| B、催化剂能降低该反应的活化能 |
| C、该反应为放热反应 |
| D、逆反应的活化能大于正反应的活化能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、O2、O3互为同位素 |
| B、乙烷、乙烯互为同分异构体 |
| C、正丁烷和异丁烷互为同系物 |
| D、1H、2H、3H、H+、H2是氢元素形成的五种不同粒子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
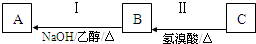 有机物A为链烃类化合物,质谱图表明其相对分子质量为70,其相关反应如图所示,其中A、B的结构中均含有2个-CH3,它们的核磁共振氢谱中均出现4个峰.请回答:
有机物A为链烃类化合物,质谱图表明其相对分子质量为70,其相关反应如图所示,其中A、B的结构中均含有2个-CH3,它们的核磁共振氢谱中均出现4个峰.请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com