
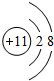 ,B元素在周期表中第3周期第ⅥA族,B与C形成常见化合物的结构式为H-S-H,A、C、D可形成常见化合物甲为氢氧化钠,用电子式表示化合物氢氧化钠的形成过程为
,B元素在周期表中第3周期第ⅥA族,B与C形成常见化合物的结构式为H-S-H,A、C、D可形成常见化合物甲为氢氧化钠,用电子式表示化合物氢氧化钠的形成过程为 ,A、B、C按1:1:1形成化合物乙的化学式为NaHS,乙属于离子化合物,甲与乙反应的离子方程式为HS-+OH-=H2O+S2-,A与D按1:1形成化合物为过氧化钠,它的电子式是
,A、B、C按1:1:1形成化合物乙的化学式为NaHS,乙属于离子化合物,甲与乙反应的离子方程式为HS-+OH-=H2O+S2-,A与D按1:1形成化合物为过氧化钠,它的电子式是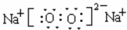 ,过氧化钠中存在的化学键为离子键和共价键,
,过氧化钠中存在的化学键为离子键和共价键,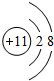 ;第3周期第ⅥA族;H-S-H;
;第3周期第ⅥA族;H-S-H;  ; NaHS;离子;HS-+OH-=H2O+S2-;
; NaHS;离子;HS-+OH-=H2O+S2-;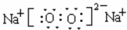 ;离子键和共价键;
;离子键和共价键;


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
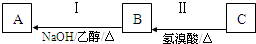 有机物A为链烃类化合物,质谱图表明其相对分子质量为70,其相关反应如图所示,其中A、B的结构中均含有2个-CH3,它们的核磁共振氢谱中均出现4个峰.请回答:
有机物A为链烃类化合物,质谱图表明其相对分子质量为70,其相关反应如图所示,其中A、B的结构中均含有2个-CH3,它们的核磁共振氢谱中均出现4个峰.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量吸收液于试管中,滴加3moL.L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中. | |
| 步骤2: | |
| 步骤3: |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol/L |
| B、标准状况下,22.4 L空气含有NA个单质分子 |
| C、1 L 0.1 mol/L氨水含有0.1NA个OH- |
| D、在18 g 18O2中含有NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向40 mL 8 mol/L的硝酸溶液中加入5.6 g铁粉Fe+4H++N03-═Fe3++NO↑+2H2O |
| B、少量SO2通入Ca(ClO)2溶液中SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO |
| C、漂白粉溶液在空气中失效ClO-+CO2+H2O═HClO+HCO3- |
| D、Ba(OH)2溶液中滴加NaHSO4溶液至中性Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com