
 短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上)戊、己分别是空气、地壳中含量最多的元素,下列判断正确的是( )
短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上)戊、己分别是空气、地壳中含量最多的元素,下列判断正确的是( )| A. | 甲一定是金属元素 | |
| B. | 气态氰化物的稳定性庚>己>戊 | |
| C. | 乙、丙、丁的最高价氧化物对应水化物可以相互反应 | |
| D. | 庚的最高价氧化物水化物酸性最强 |
分析 短周期元素甲、乙、丙、丁、戊、己、庚,戊、己分别是空气、地壳中含量最多的元素,则戊为氮元素,己为氧元素,所以丁、戊、己、庚为第二周期元素,则乙、丙为第三周期元素,甲不一定在丁、庚的连线上,则甲为第一周期元素,则甲为氢元素,根据元素在周期表中位置关系可知,乙为镁元素,丙为铝,丁为碳元素,庚为氟元素,据此答题.
解答 解:短周期元素甲、乙、丙、丁、戊、己、庚,戊、己分别是空气、地壳中含量最多的元素,则戊为氮元素,己为氧元素,所以丁、戊、己、庚为第二周期元素,则乙、丙为第三周期元素,甲不一定在丁、庚的连线上,则甲为第一周期元素,则甲为氢元素,根据元素在周期表中位置关系可知,乙为镁元素,丙为铝,丁为碳元素,庚为氟元素,
A.根据上面的分析可知,甲为氢元素,为非金属元素,故A错误;
B.气态氢化物的稳定性HF>H2O>NH3,故B正确;
C.氢氧化镁与氢氧化铝不能反应,故C错误;
D.庚为氟元素,氟元素没有最高正价,故D错误;
故选B.
点评 本题考查结构性质位置关系,明确元素是解题关键,侧重对基础知识的巩固.


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:解答题
 某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.利用如图装置可以验证非金属性的变化规律.
某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.利用如图装置可以验证非金属性的变化规律.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
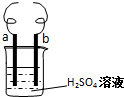 用电极a(铁丝)、电极b(铜丝)和H2SO4溶液可以构成原电池或电解池,如图所示.
用电极a(铁丝)、电极b(铜丝)和H2SO4溶液可以构成原电池或电解池,如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用可降解的“玉米塑料”替代一次性饭盒,可减少白色污染 | |
| B. | 乙烯、聚氯乙烯都能使溴水褪色 | |
| C. | 保鲜膜、一次性食品袋的主要成分是聚氯乙烯 | |
| D. | 人造纤维、合成纤维和光导纤维都是有机高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
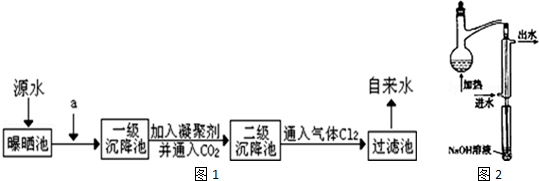
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | OH-、K+、CO32-、Cl2 | B. | Na+、OH-、NH4+、Cl- | ||
| C. | Fe3+、Na+、NH3.H2O、NO3- | D. | K+、Al3+、Cl-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com